
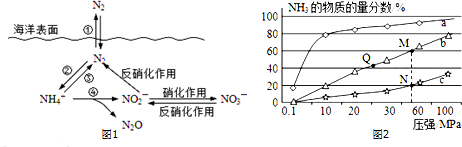
分析 Ⅰ.(1)氮的固定作用是指游离态氮元素发生反应生成化合态氮元素的过程为固氮作用,即单质变化为化合物;
(2)有氧时,在硝化细菌作用下,NH4+可实现过程④的转化,生成N2O、NO2-、H+和水,结合电荷守恒和原子守恒配平书写离子方程式得到;
Ⅱ.(1)正反应是放热反应,升高温度平衡逆向移动,氨气的含量减小;
(2)A.减小生成物浓度平衡正向移动;
B.K只受温度影响,温度不变平衡常数不变,正反应为放热反应,升高温度平衡逆向移动,平衡常数减小;
C.温度越高反应速率越快;
D.压强增加还需考虑材料的强度.
(3)计算平衡时各组分浓度,代入K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})×{c}^{3}({H}_{2})}$计算平衡常数;
Ⅲ.(1)已知:①2NH3(g)+CO2(g)═H2NCOONH4(s)△H=-272kJ•mol-1;
②H2NCOONH4(s)═CO(NH2)2(s)+H2O(g)△H=+138kJ•mol-1;
根据盖斯定律,①+②可得:2NH3(g)+CO2(g)?H2O(g)+CO(NH2)2 (s);
(2)①分析图象计算10分钟时二氧化碳的消耗物质的量,结合化学反应速率概念进行计算;
②已知总反应的快慢由慢的一步决定,反应快慢可以依据第一步和第二步反应的曲线斜率比较大小;
解答 解:Ⅰ.(1)氮的固定作用是指游离态氮元素发生反应生成化合态氮元素的过程为固氮作用,即单质变化为化合物,分析转化关系图可知只有反应②是氮气保护为铵根离子是固氮作用,
故答案为:②;
(2)有氧时,在硝化细菌作用下,NH4+可实现过程④的转化,生成N2O、NO2-、H+和水,氮元素化合价-3价变化为+1价和+3价,氧元素化合价0价变化为-2价,电子转移总数20e-,所以铵根离子前为4,氧气前为5,NO2-前为2,N2O前为1,结合电荷守恒得到氢离子前为6,水分子式前为5,配平得到离子方程式为:4NH4++5O2═2NO2-+6H++N2O+5H2O,
故答案为:4,6,1N2O,5H2O;
Ⅱ.(1)合成氨的反应为放热反应,反应温度越高,越不利于反应正向进行,曲线a的氨气的物质的量分数最高,其反应温度对应相对最低,所以a曲线对应温度为200°C;
故答案为:200℃;
(2)A.及时分离出NH3,可以使平衡正向进行,可以提高H2的平衡转化率,故A正确;
B.平衡常数与温度有关,与其他条件无关,温度相同时平衡常数相同,反应是放热反应,温度越高平衡常数越小,则M、N、Q点平衡常数K的大小关系是K(M)=K(Q)>K(N),故B正确;
C.N点温度高于M点,温度越低反应速率越快,故N点比M点的反应速率快,故C错误;
D.压强增加还需考虑材料的强度,故D错误.
故答案为:AB
(3)N点时c(NH3)=0.2mol•L-1,氨气体积分数为20%,则:
N2(g)+3H2(g)?2NH3(g)
起始浓度(mol/L):x 3x 0
变化浓度(mol/L):0.1 0.3 0.2
平衡浓度(mol/L):x-0.1 3x-0.3 0.2
所以$\frac{0.2}{4x-0.2}$=20%,解得x=0.3,平衡常数K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})×{c}^{3}({H}_{2})}$=$\frac{0.{2}^{2}}{0.2×0.{6}^{3}}$≈0.93L2/mol2,
故答案为:0.93
Ⅲ.(1)已知:①2NH3(g)+CO2(g)═H2NCOONH4(s)△H=-272kJ•mol-1;
②H2NCOONH4(s)═CO(NH2)2(s)+H2O(g)△H=+138kJ•mol-1;
根据盖斯定律,①+②可得:2NH3(g)+CO2(g)?H2O(g)+CO(NH2)2 (s)△H=-134kJ/mol,
故答案为:2NH3(g)+CO2(g)?H2O(g)+CO(NH2)2 (s)△H=-134kJ/mol;
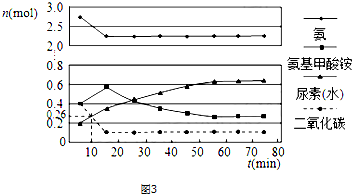
(2)①依据图象分析,二氧化碳再进行到10min时物质的量为0.26mol,所以此时的反应速率为=$\frac{\frac{1mol-0.26mol}{0.5L}}{10min}$=0.148mol/(L•min),
故答案为:0.148;
②由图象可知在15分钟左右,氨气和二氧化碳反应生成氨基甲酸铵后不再变化发生的是第一步反应,氨基甲酸铵先增大再减小最后达到平衡,发生的是第二步反应,从曲线斜率不难看出第2步反应速率慢,所以合成尿素总反应的快慢由第2步反应决定,根据图可知,尿素在55分钟时,物质的量不再变化,即反应达到平衡,所以总反应进行到55min时到达平衡,
故答案为:二;55.
点评 本题考查化学平衡计算与影响因素、化学平衡图象、热化学方程式的书写、盐类水解等,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及化学计算能力,题目难度中等.


 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 配制银氨溶液:在一定量AgNO3溶液中,滴加氨水至沉淀溶解 | |
| B. | 配制Cu(OH)2悬浊液:在一定量CuSO4溶液中,加入少量NaOH溶液 | |
| C. | 制备氯乙烷(C2H5Cl):将乙烷和氯气的混合气放在光照条件下反应 | |
| D. | 乙烯和乙醛均能使酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将作物秸秆通过化学反应转化为乙醇用作汽车燃料 | |
| B. | 大力研发新型有机溶剂替代水作为萃取剂 | |
| C. | 利用CO2合成聚碳酸酯类可降解塑料,实现“碳”的循环利用 | |
| D. | 使用资源节约型、环境友好型的生物降解塑料包装袋 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
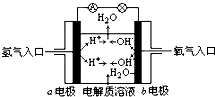
| A. | b电极是负极 | |
| B. | 总反应方程式为:2H2+O2═2H2O | |
| C. | 负极发生还原反应,正极发生氧化反应 | |
| D. | 氢氧燃料电池是一种具有广泛应用前景的绿色电源 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某学生用0.100mol•L-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分为如下几步:
某学生用0.100mol•L-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分为如下几步:| 实验 编号 | KOH溶液的浓度(mol•L-1) | 滴定完成时,滴入KOH溶液的体积(mL) | 待测盐酸溶液的体积(mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32 g O2气体含有的氧原子数为NA | |
| B. | 2 L 0.3 mol/L Na2SO4溶液中含有Na+为0.6NA | |
| C. | 54 g铝完全反应后失去的电子数为6NA | |
| D. | 11.2 L氮气所含的分子数为0.5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com