
分析 (1)依据n=$\frac{m}{M}$,c=$\frac{n}{V}$计算氢气物质的量的变化量,依据V=$\frac{△C}{△t}$计算用V(H2),同一反应用不同物质表示的速率之比等于计量系数之比,计算V(CO);
化学反应中,改变固体或者纯液体的量,反应速率不变;
(2)可逆反应达到平衡状态,一定满足正逆反应速率相等且不为零,各组分的浓度不再变化;该反应的特点为:一是可逆反应;二是反应前后气体体积不相等,据此判断反应是否达到平衡状态;
(3)升高温度平衡向吸热反应方向移动.
解答 解:(1)若容器容积为2L,反应10s氢气质量增加0.4g,则n(H2)=$\frac{0.4g}{2g/mol}$=0.2mol,则△C=$\frac{\frac{0.2mol}{2L}}{10s}$=0.01mol/L;同一反应用不同物质表示的速率之比等于计量系数之比,即V(H2):V(CO)=1:1,所以V(CO)=0.01mol/L;碳为固体,若增加碳的量,反应物浓度不变,反应速率不变;
故答案为:0.01; 不变;
(2)a.C(s)+H2O(g)?CO(g)+H2(g)该反应为反应前后气体体积改变的反应,压强不变可以证明达到平衡,故a选;
b.v正(H2)=v正(H2O),都表示正方向速率,无论是否达到平衡状态,同一方向,用不同物质表示的速率之比都等于计量系数之比,故a不选;
c.达到平衡后各物质浓度保持不变,所以当c(CO)不变可以判断反应达到平衡状态,故c选;
d.c(H2O)=c(CO) 不能证明正逆反应速率相同,不能说明反应物、生成物浓度不变,不能证明反应达到平衡状态,故d不选;
故选:ac;
(3)升高温度平衡向吸热反应方向移动,若升高温度,平衡向右移动,说明正方向为吸热反应,
故答案为:吸热.
点评 本题考查化学反应速率和化学平衡的影响因素、化学平衡状态判断、热化学方程式含义等知识点,掌握基础是解题关键,题目难度不大.


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | NaOH与HCl 反应 | B. | CO与O2点燃 | ||
| C. | Ba(OH)2•8H2O与NH4NO3反应 | D. | SO3与H2O反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②是化合反应 | B. | ①②③是氧化还原反应 | ||
| C. | ①③是置换反应 | D. | ①③是复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
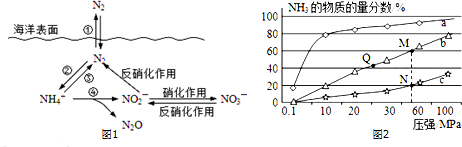
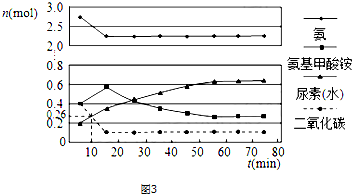
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+(aq)+OH-(aq)=H2O(l)△H=-a kJ/mol,故1 mol NaOH固体与足量的稀盐酸反应,出热量为a kJ | |
| B. | 因CuSO4•5H2O(s)=CuSO4(s)+5H2O(l)△H=+b kJ/mol,故1 mol CuSO4(s)溶于水时,放出热量b kJ | |
| C. | 因氢气的燃烧热为c kJ/mol,故电解水的热化学方程式为:2H2O(l)=2H2(g)+O2(g)△H=+c kJ/mol | |
| D. | 因N2(g)+3H2(g)?2NH3(g)△H=-d kJ/mol,故在某容器中投入1 mol N2与3 mol H2充分反应后,放出热量小于d kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.4g金属镁变成镁离子时失去的电子数目为0.1NA | |
| B. | 标准状况下,2.24LBr2所含的分子数为0.1NA | |
| C. | 室温下,32gO2和O3的混合气体中含有的氧原子数为2NA | |
| D. | 1.0mol•L-1的Na2CO3溶液中含有的Na+离子数目为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com