
| A. | 着色剂 | B. | 防腐剂 | C. | 调味剂 | D. | 营强化剂g |
科目:高中化学 来源: 题型:选择题
| A. | Cs+、K+、Mg2+、Al3+ | B. | F、F-、Cl-、Br- | ||
| C. | Ca2+、K+、S2-、Cl- | D. | Al、Al3+、Mg、K |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
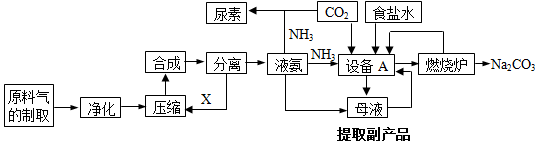
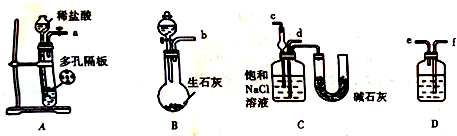
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
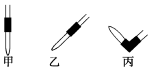 某学生用0.100mol•L-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分为如下几步:
某学生用0.100mol•L-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分为如下几步:| 实验 编号 | KOH溶液的浓度(mol•L-1) | 滴定完成时,滴入KOH溶液的体积(mL) | 待测盐酸溶液的体积(mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把烧杯内的溶液转移到容量瓶中时,必须用玻璃棒引流 | |
| B. | 用100mL量筒量取95.20 mL盐酸 | |
| C. | 用托盘天平称取25.20gNaCl | |
| D. | 用500mL容量瓶配制50mL0.10mol/L溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,48gO3含有的氧原子数为3NA | |
| B. | 1 mol OH-所含的电子数为9NA | |
| C. | 常温常压下,11.2 L氧气所含的原子数为NA | |
| D. | 物质的量浓度为1mol/L MgCl2溶液,含有Cl-离子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙中C的转化率为75% | |
| B. | 反应.达到平衡前,甲中始终有V正>V逆,乙中始终有V正<V逆 | |
| C. | 在该条件下,反应2C(g)?A(g)+3B(g)的平衡常数为2.7×1.54 | |
| D. | 乙中的热化学方程式为2C(g))?A(g)+3B(g)△H=+Q2kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com