
 某学生用0.100mol•L-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分为如下几步:
某学生用0.100mol•L-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分为如下几步:| 实验 编号 | KOH溶液的浓度(mol•L-1) | 滴定完成时,滴入KOH溶液的体积(mL) | 待测盐酸溶液的体积(mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
分析 (1)中和滴定有检漏、洗涤、润洗、装液、取待测液于锥形瓶,然后加入指示剂进行滴定等操作;
(2)碱式滴定管中排气泡的方法:把滴定管的胶头部分稍微向上弯曲,再排气泡,
(3)滴定管需要润洗2-3次防止滴定管内壁附着的水将标准溶液稀释而带来误差;
(4)根据c(待测)=$\frac{V(标准)c(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差;
(5)如溶液颜色变化且半分钟内不变色,可说明达到滴定终点;
(6)先分析数据的有效性,求出消耗碱的平均体积,然后根据c(酸)=$\frac{c(碱)V(碱)}{c(酸)}$计算.
解答 解:(1)操作的步骤是选择滴定管,然后洗涤、装液、使尖嘴充满溶液、固定在滴定台上,然后调节液面记下读数,再取待测液于锥形瓶,然后加入指示剂进行滴定,所以顺序为:B、D、C、E、A、F,
故答案为:B、D、C、E、A、F;
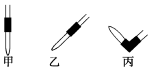
(2)碱式滴定管的气泡通常橡皮管内,只要将滴定玻璃头朝上,并挤橡皮管中的玻璃珠就可以将气泡冲排出,
故答案为:丙;
(3)滴定管用蒸馏水洗涤后,内壁有一层水膜,如果直接装液会使浓度降低,所以必须用标准溶液润洗滴定管2-3次,
故答案为:防止滴定管内壁附着的水将标准溶液稀释而带来误差;
(4)锥形瓶用蒸馏水洗涤后,如果再用待测液润洗,会使锥形瓶内溶质的物质的量增大,会造成V(标准)偏大,根据c(待测)=$\frac{V(标准)c(标准)}{V(待测)}$,会造成结果偏高,故答案为:偏高;
(5)本实验是用KOH滴定盐酸溶液,用酚酞作指示剂,所以终点时,现象是当溶液由无色变为浅红色,且在半分钟内不褪色,
故答案为:滴入最后一滴KOH溶液,溶液由无色变为浅红色,且在半分钟内不褪色;
(6)三次数据均有效,平均消耗V(KOH溶液)=$\frac{22.62+22.72+22.80}{3}mL$=22.71mL,所以c(酸)=$\frac{c(碱)V(碱)}{c(酸)}$=$\frac{0.100mol/L×20.00×1{0}^{-3}L}{22.71×1{0}^{-3}L}$=0.09 mol/L,
故答案为:0.09 mol/L.
点评 本题考查了中和滴定及误差分析,要求选择掌握中和滴定的操作方法,试题难易适中,注重灵活性,侧重对学生能力的培养和解题方法的指导和训练,有利于培养学生的逻辑思维能力和严谨的规范实验操作能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LSO3所含的分子数为NA | |
| B. | 49g硫酸中所含氧原子的数目为2NA | |
| C. | 1molNH4+所含质子数为10NA | |
| D. | 0.5L 0.2 mol•L-1硫酸钠溶液中含有的SO42-离子数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{200×P%×ρ}{36.5}$ | B. | $\frac{1000×P%×ρ}{36.5}$ | C. | $\frac{200×P%}{36.5}$ | D. | $\frac{ρ×P%}{1000×36.5}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定是酸的溶液 | B. | 一定是碱的溶液 | ||
| C. | 一定是碱性溶液 | D. | 可能是酸性溶液也可能是碱性溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com