
| A. | 一定是酸的溶液 | B. | 一定是碱的溶液 | ||
| C. | 一定是碱性溶液 | D. | 可能是酸性溶液也可能是碱性溶液 |
分析 酸或碱、强酸酸式盐抑制水的电离,含有弱离子的盐促进水电离,常温时某溶液中由水电离出的c(H+)为1.0×10-12mol•L-1<1.0×10-7mol•L-1,抑制了水的电离,说明溶液中的溶质为酸、碱或强酸酸式盐,据此分析解答.
解答 解:常温下某溶液中由水电离出的c(H+)为1.0×10-12mol•L-1<1.0×10-7mol•L-1,说明该溶液中的溶质抑制了水的电离,可能为酸、碱或强酸酸式盐,则该溶液可能为酸性溶液也可能是碱性溶液,
故选D.
点评 本题考查了溶液酸碱性判断,题目难度不大,明确促进或抑制水电离物质是解本题关键,注意溶液中氢离子浓度与水电离出氢离子浓度关系,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:实验题
 某学生用0.100mol•L-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分为如下几步:
某学生用0.100mol•L-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分为如下几步:| 实验 编号 | KOH溶液的浓度(mol•L-1) | 滴定完成时,滴入KOH溶液的体积(mL) | 待测盐酸溶液的体积(mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32 g O2气体含有的氧原子数为NA | |
| B. | 2 L 0.3 mol/L Na2SO4溶液中含有Na+为0.6NA | |
| C. | 54 g铝完全反应后失去的电子数为6NA | |
| D. | 11.2 L氮气所含的分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890kJ•mol-1 | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=+890kJ•mol-1 | |
| C. | CH4(g)+O2(g)═CO2(g)+H2O(l)△H=-890kJ•mol-1 | |
| D. | 2CH4(g)+4O2(g)═2CO2(g)+4H2O(g)△H=+890kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙中C的转化率为75% | |
| B. | 反应.达到平衡前,甲中始终有V正>V逆,乙中始终有V正<V逆 | |
| C. | 在该条件下,反应2C(g)?A(g)+3B(g)的平衡常数为2.7×1.54 | |
| D. | 乙中的热化学方程式为2C(g))?A(g)+3B(g)△H=+Q2kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 往氨水中滴加酚酞 | B. | NO气体暴露在空气中 | ||
| C. | Cl2通过湿润的有色布条 | D. | 往NaOH溶液中通入CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
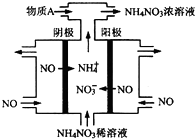 氮可形成多种氧化物,如NO、NO2、N2O4等.
氮可形成多种氧化物,如NO、NO2、N2O4等.| 时间/s | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
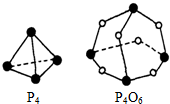 白磷(P4)和P4O6的分子结构如图.现提供以下化学键的键能:P-P为E1kJ•mol-1、P-O为E2kJ•mol-1、O=O为E3 kJ•mol-1.则:P4(s)+3O2(g)═P4O6(s)的反应热△H=kJ•mol-1(6E1+3E3-12E2)kJ•mol-1(用E1,E2,E3表示).
白磷(P4)和P4O6的分子结构如图.现提供以下化学键的键能:P-P为E1kJ•mol-1、P-O为E2kJ•mol-1、O=O为E3 kJ•mol-1.则:P4(s)+3O2(g)═P4O6(s)的反应热△H=kJ•mol-1(6E1+3E3-12E2)kJ•mol-1(用E1,E2,E3表示).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中导电粒子的数目减少 | |
| B. | 醋酸的电离程度增大,c(H+)亦增大 | |
| C. | 溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c({H}^{+})}$不变 | |
| D. | 溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com