
| A. | H+H→H2 | B. | H+Cl→HCl | C. | I2→I+I | D. | S+O2→SO2 |
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:实验题
| 实验次数 | 初读数(mL) | 末读数(mL) |
| 1 | 0.00 | 18.50 |
| 2 | 0.00 | 22.45 |
| 3 | 0.00 | 18.48 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制银氨溶液:在一定量AgNO3溶液中,滴加氨水至沉淀溶解 | |
| B. | 配制Cu(OH)2悬浊液:在一定量CuSO4溶液中,加入少量NaOH溶液 | |
| C. | 制备氯乙烷(C2H5Cl):将乙烷和氯气的混合气放在光照条件下反应 | |
| D. | 乙烯和乙醛均能使酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Br2是氧化剂,NaOH是还原剂 | |
| B. | Br2既是氧化剂又是还原剂 | |
| C. | 被氧化的Br原子和被还原的Br原子的物质的量的比为5:1 | |
| D. | 每生成1mol的NaBrO3转移10mol的电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cs+、K+、Mg2+、Al3+ | B. | F、F-、Cl-、Br- | ||
| C. | Ca2+、K+、S2-、Cl- | D. | Al、Al3+、Mg、K |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 107:107:1:1 | B. | 1:10:107:107 | C. | 107:106:2:2 | D. | 107:106:2×107:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将作物秸秆通过化学反应转化为乙醇用作汽车燃料 | |
| B. | 大力研发新型有机溶剂替代水作为萃取剂 | |
| C. | 利用CO2合成聚碳酸酯类可降解塑料,实现“碳”的循环利用 | |
| D. | 使用资源节约型、环境友好型的生物降解塑料包装袋 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
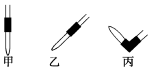 某学生用0.100mol•L-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分为如下几步:
某学生用0.100mol•L-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分为如下几步:| 实验 编号 | KOH溶液的浓度(mol•L-1) | 滴定完成时,滴入KOH溶液的体积(mL) | 待测盐酸溶液的体积(mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com