
| A. | 107:107:1:1 | B. | 1:10:107:107 | C. | 107:106:2:2 | D. | 107:106:2×107:2 |
分析 根据H2O?H++OH-可知,H2SO4溶液、Ba(OH)2溶液抑制水的电离,根据溶液的H2SO4溶液的PH或Ba(OH)2溶液中c(OH-)计算水的电离的物质的量,1mol/LNaCl溶液中对水电离无影响,根据离子积常数和离子浓度可直接求出发生电离的水的物质的量,进而计算物质的量之比.
解答 解:设溶液的体积为1L,
①0.5mol/L的H2SO4溶液中c(H+)=1.0 mol•L-1,c(OH-)=1.0×10-14mol•L-1,水电离的物质的量为1.0×10-14mol;
②0.05mol/LBa(OH)2溶液中c(OH-)=0.1 mol•L-1,c(H+)=1.0×10-13mol•L-1,水电离的物质的量为1.0×10-13mol;
③1mol/LNaCl溶液中c(OH-)=1.0×10-7mol•L-1,水的电离的物质的量为1.0×10-7mol;
④纯水中c(H+)=1.0×10-7mol•L-1,水的电离的物质的量为1.0×10-7mol;
故①②③④中水的电离的物质的量之比为1.0×10-14mol:1.0×10-13mol:1.0×10-7mol1:1.0×10-7mol=1:10:107:107,
故选B.
点评 本题考查水的电离以及溶液中pH的简单计算,为高频考点,侧重于学生的分析能力和计算能力的考查,难度不大,做题时注意如何计算水的电离是解答此类题目的关键.


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:选择题
| A. | 此反应是氧化还原反应 | |
| B. | N2O4在反应中作还原剂 | |
| C. | 反应瞬间产生大量高温气体,推动火箭飞行 | |
| D. | R的分子式为C2H8N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 倭铅是指金属锌和铅的混合物 | B. | 煤炭中起作用的主要成分是C | ||
| C. | 我国历史上铅的使用早于锌 | D. | 该冶炼锌的方法属于热还原法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,32gO2和O3的混合气体中含有的氧原子数为2NA | |
| B. | 在常温常压下,11.2LN2含有的分子数为0.5NA | |
| C. | 0.5 mol•L-1MgCl2溶液中,含有Cl-个数为NA | |
| D. | 18 g NH4+中所含的电子数为11NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
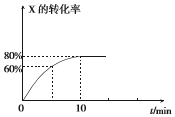 恒定温度为T1℃时,在容积为10L的密闭容器中充人1.0mol X和0.80mol Y,发生反应:
恒定温度为T1℃时,在容积为10L的密闭容器中充人1.0mol X和0.80mol Y,发生反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (1)(2)(3) | B. | (1)(3)(6) | C. | (1)(2)(5)(6) | D. | (1)(3)(6)(7) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LSO3所含的分子数为NA | |
| B. | 49g硫酸中所含氧原子的数目为2NA | |
| C. | 1molNH4+所含质子数为10NA | |
| D. | 0.5L 0.2 mol•L-1硫酸钠溶液中含有的SO42-离子数目为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com