
分析 发生反应:Fe+2HCl═FeCl2+H2↑,根据n=$\frac{m}{M}$计算Fe的物质的量,根据方程式计算消耗HCl、生成氢气的物质的量,再根据V=nVm计算生成氢气的体积.
解答 解:56gFe的物质的量=$\frac{56g}{56g/mol}$=1mol,
令消耗HCl的物质的量为x,生成氢气的物质的量为y,则:
Fe+2HCl═FeCl2+H2↑
1 2 1
1mol x y
所以x=$\frac{1mol×2}{1}$=2mol,
y=$\frac{1mol×1}{1}$=1mol,
标况下1mol氢气的体积=1mol×22.4L/mol=22.4L,
答:消耗HCl的物质的量为2mol,标况下生成氢气的体积为22.4L.
点评 本题考查了物质的量的计算、化学方程式的计算,题目难度不大,明确发生反应的实质为解答关键,注意掌握物质的量与摩尔质量、气体摩尔体积的关系,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 只含一种元素的物质一定是单质 | B. | 只含一种分子的物质一定纯净物 | ||
| C. | 非金属氧化物一定是酸性氧化物 | D. | 有单质生成的反应一定是置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH与HCl 反应 | B. | CO与O2点燃 | ||
| C. | Ba(OH)2•8H2O与NH4NO3反应 | D. | SO3与H2O反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol KClO3 | B. | 49g H3PO4 | ||
| C. | 标准状况下5.6L氧气 | D. | 3.01×1023个CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
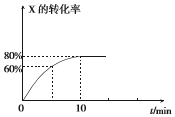 恒定温度为T1℃时,在容积为10L的密闭容器中充人1.0mol X和0.80mol Y,发生反应:
恒定温度为T1℃时,在容积为10L的密闭容器中充人1.0mol X和0.80mol Y,发生反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②是化合反应 | B. | ①②③是氧化还原反应 | ||
| C. | ①③是置换反应 | D. | ①③是复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
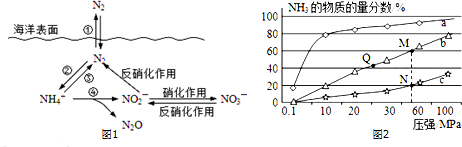
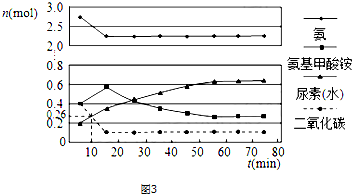
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com