
分析 (1)胶体粒子直径大小在1nm~100nm;FeCl3与水在加热条件下反应生成氢氧化铁胶体和氯化氢;
(2)搅拌能使胶体聚沉;
(3)氢氧化铁胶体先发生聚沉,然后盐酸溶液与氢氧化铁反应.
解答 解:(1)氢氧化铁胶体是胶体分散系中的一种,胶体粒子直径大小在1nm~100nm;生成红褐色胶体的反应为FeCl3与水在加热条件下生成氢氧化铁胶体和氯化氢,方程式为:FeCl3+3H2O $\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl,故答案为:1nm~100nm; FeCl3+3H2O $\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl;
(2)搅拌能使胶体聚沉,原因是搅拌能减弱胶粒对电荷的吸附能力,使胶粒容易碰撞结合成更大的颗粒而聚沉,故边滴加溶液边用玻璃棒搅拌,会导致制备胶体失败,故答案为:搅拌使胶体发生聚沉而出现浑浊;
(3)向Fe(OH)3胶体中逐滴滴加盐酸至过量,先胶体和电解质溶液产生聚沉现象,有沉淀生成,后氢氧化铁又和盐酸反应生成可溶性的氯化铁,所以沉淀又溶解,故答案为:先出现浑浊后浑浊逐渐消失.
点评 本题要求熟练掌握胶体的制备知识,题目难度不大,特别是氢氧化铁胶体的制备方程式是常考常错的内容,胶体的聚沉以及沉淀的溶解一直是具有一定综合性的热点.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某学生用0.100mol•L-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分为如下几步:
某学生用0.100mol•L-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分为如下几步:| 实验 编号 | KOH溶液的浓度(mol•L-1) | 滴定完成时,滴入KOH溶液的体积(mL) | 待测盐酸溶液的体积(mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把烧杯内的溶液转移到容量瓶中时,必须用玻璃棒引流 | |
| B. | 用100mL量筒量取95.20 mL盐酸 | |
| C. | 用托盘天平称取25.20gNaCl | |
| D. | 用500mL容量瓶配制50mL0.10mol/L溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2+F2═2HF | B. | 3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$ 2Fe+3CO2 | ||
| C. | NaOH+HCl═NaCl+H2O | D. | 4HNO3$\frac{\underline{\;\;△\;\;}}{\;}$ 2H2O+4NO2↑+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,48gO3含有的氧原子数为3NA | |
| B. | 1 mol OH-所含的电子数为9NA | |
| C. | 常温常压下,11.2 L氧气所含的原子数为NA | |
| D. | 物质的量浓度为1mol/L MgCl2溶液,含有Cl-离子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32 g O2气体含有的氧原子数为NA | |
| B. | 2 L 0.3 mol/L Na2SO4溶液中含有Na+为0.6NA | |
| C. | 54 g铝完全反应后失去的电子数为6NA | |
| D. | 11.2 L氮气所含的分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
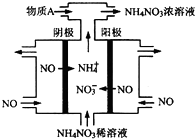 氮可形成多种氧化物,如NO、NO2、N2O4等.
氮可形成多种氧化物,如NO、NO2、N2O4等.| 时间/s | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com