
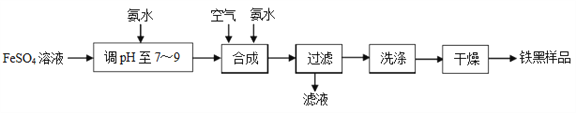
【题目】铁黑(Fe3O4)是常见的铁系颜料.一种制取铁黑的实验流程如下图所示:
制取铁黑的反应原理可表示为Fe(OH)2+2Fe(OH)3![]() Fe(OH)2·2Fe(OH)3
Fe(OH)2·2Fe(OH)3![]() Fe3O4
Fe3O4
(1)加入氨水调pH至7~9时,发生反应的离子方程式为_______________。
(2)为了保证铁黑样品的质量,“合成”中需要控制的因素有______________(填三个)。
(3)铁黑产品中Fe3O4的含量是判断产品等级的依据之一。某铁黑样品中混有的杂质为FeO、Fe2O3中的一种。根据国标方法,进行的测定实验如下:
步骤1:称取1.908g样品置于锥形瓶中,加入足量盐酸,加热使之完全溶解。
步骤2:向锥形瓶中先加入足量的SnCl2溶液,将Fe3+全部转化为Fe2+,除去过量的Sn2+,再加入一定量的硫酸和磷酸,并滴加指示剂。
步骤3:再向锥形瓶中滴加0.08200mol·L-1K2Cr2O7溶液,发生反应:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
恰好完全反应时,共消耗50.00mL K2Cr2O7溶液。请计算样品中Fe3O4的质量分数_____________(写出计算过程)。
【答案】 Fe2+ + 2NH3·H2O = Fe(OH)2↓+ 2NH4+ 氨水的用量、通入空气的量(或氢氧化亚铁与空气的比例)、反应温度等 n(Fe2+)=6n(Cr2O72-)=6×0.08200mol·L-1×50.00×10-3 L=0.0246mol
1.908g样品中铁元素总质量为:m(Fe)= 0.0246mol×56 g·mol -1=1.3376g
1.908g样品中氧元素总质量为:m(O)= 1.908g -1.3376g=0.5304g
n(O)= 0.5304g/16 g·mol -1=0.03315mol
n(O)/n(Fe)=1.348>4/3,所以铁黑样品中混有的杂质为Fe2O3
设Fe3O4的物质的量为x,Fe2O3的物质的量为y
![]()
x=0.0076mol,y=0.0009mol
样品中Fe3O4的质量分数=![]() =92.41%
=92.41%
【解析】(1)在FeSO4溶液中滴加氨水调pH至7~9时,会有生成Fe(OH)2,发生反应的离子方程式为Fe2+ + 2NH3·H2O = Fe(OH)2↓+ 2NH4+;
(2)Fe(OH)2在空气中易氧化而生成Fe(OH)3,为保证铁黑样品的质量,“合成”中需要控制的因素有氨水的用量、通入空气的量(或氢氧化亚铁与空气的比例)、反应温度等。
(3)n(Fe2+)=6n(Cr2O72-)=6×0.08200mol·L-1×50.00×10-3 L=0.0246mol
1.908g样品中铁元素总质量为:m(Fe)= 0.0246mol×56 g·mol -1=1.3376g
1.908g样品中氧元素总质量为:m(O)= 1.908g -1.3376g=0.5304g,n(O)= 0.5304g/16 g·mol -1=0.03315mol;
n(O)/n(Fe)=1.348>4/3,所以铁黑样品中混有的杂质为Fe2O3
设Fe3O4的物质的量为x,Fe2O3的物质的量为y;
3x+2y=0.0246mol、4x+3y=0.03315mol 解得:x=0.0076mol、y=0.0009mol;
则样品中Fe3O4的质量分数=![]() ×100%=92.41%。
×100%=92.41%。


科目:高中化学 来源: 题型:
【题目】对于苯乙烯(![]() )的下列叙述中:①能使酸性KMnO4溶液褪色;②可发生加聚反应;③可溶于水;④可溶于苯;⑤能发生硝化反应;⑥所有的原子可能共平面。其中正确的是
)的下列叙述中:①能使酸性KMnO4溶液褪色;②可发生加聚反应;③可溶于水;④可溶于苯;⑤能发生硝化反应;⑥所有的原子可能共平面。其中正确的是
A. ①②③④⑤ B. ①②⑤⑥ C. ①②④⑤⑥ D. 全部正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(12分)以苯酚为原料的合成路线如下所示,请按要求作答:
(1)写出以下物质的结构简式:B F
(2)写出反应①④的化学反应方程式:
①
④
(3)反应⑤可以得到E,同时可能得到的副产物的结构简式为:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在①、②、③容积不等的恒容密闭容器中,均充入0.lmolCO和0.2molH2,在催化剂的作用下发生反应:CO(g)+2H2(g) ![]() CH3OH(g)。测得三个容器中平衡混合物中CH3OH的体积分数随温度的变化如图所示:
CH3OH(g)。测得三个容器中平衡混合物中CH3OH的体积分数随温度的变化如图所示:

下列说法正确的是
A. 该反应的正反应为放热反应
B. 三个容器容积:①>②>③
C. 在P点,CO转化率为75%
D. 在P点,向容器②中再充入CO、H2 及 CH3OH 各 0.025mol,此时 v(CO)正<v (CO)逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将绿豆大小方形金属钠,投入足量且含酚酞的水中,根据相应现象不能得出的结论是 ( )
选项 | 实验现象 | 结论 |
A | 方形金属钠变成小球 | 方形钠反应速率快 |
B | 钠浮于水面游动 | 水的密度大于钠 |
C | 酚酞溶液变成红色 | 有NaOH生成 |
D | 钠球游动,有吱吱声 | 有气体生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将适量铁粉放入三氯化铁溶液中,完全反应后,溶液中Fe2+和Fe3+浓度相等。则已反应的Fe3+和未反应的Fe3+的物质的量之比是
A. 2 : 3 B. 3:2 C.1:2 D.1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘化钠是一种白色结晶粉末,医疗上可用于甲状腺肿瘤防治剂、祛痰剂等。实验室用NaOH、单质碘和水合肼为原料制得,部分装置如下图所示。

实验步骤如下:
步骤①向三口烧瓶中加入8.2 gNaOH及30 mL水,搅拌冷却。
步骤②向制得的NaOH溶液中加入25.4 g单质碘,开动磁力搅拌器,保持6070℃至反应充分。
步骤③向步骤②所得溶液中加入稍过量的N2H4·H2O(水合肼),还原NaIO和NaIO3,得Nal溶液粗品和空气中常见的某气体。
步骤④向溶液③中加入1.0 g活性炭,煮沸半小时,然后将溶液与活性炭分离。
步骤⑤蒸发浓缩、结晶、过滤及干燥得产品24.3 g。
(1)步骤②温度不宜超过70℃的原因是__________;该步骤反应完全的现象是___________。
(2)步骤③N2 H4·H2O还原NaIO3的化学方程式为_______________。
(3)步骤④加入活性炭的目的是________;“将溶液与活性炭分离”的方法是__________。
(4)本次实验成品率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室进行下列实验时,要用到温度计,且温度计水银球置于反应物液面以下的是( )
A. 用蒸馏方法提纯水B. 乙醛的银镜反应
C. 实验室制乙烯D. 实验室制取硝基苯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com