
| A.工业合成氨的过程是固氮的过程 |
| B.为防止粮食、罐头、水果等食品腐烂,常用氮气做保护气 |
| C.CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 |
| D.过量SO2通入紫色石蕊试液,溶液只变红不褪色 |


科目:高中化学 来源:不详 题型:填空题
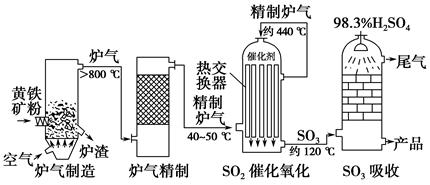
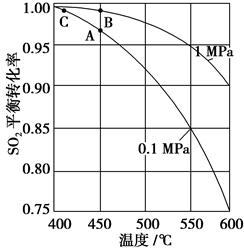
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.空气量越大越好 | B.将煤气化处理 |
| C.将固体燃料粉碎 | D.将液体燃料雾化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.是社会发展进步的关键 | B.能创造新物质 |
| C.提供能源和动力 | D.是所有污染的源泉 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.寻求氮气新来源 |
| B.研制低温下活性较大的催化剂 |
| C.研制500℃左右活性较大的催化剂 |
| D.研制耐高温、高压的新材料 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
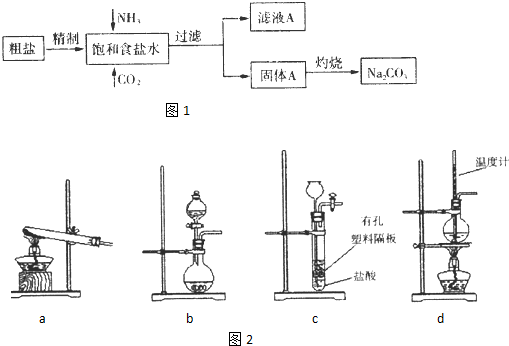
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.元素分析仪可同时对有机物中碳、氢、氧、硫等多种元素进行分析,其特点是样品量少,速度快 |
| B.1H核磁共振谱能反映出有机物中不同环境氢原子的种数和个数 |
| C.根据红外光谱图的分析可以初步判断有机物中具有哪些基团 |
| D.同位素示踪法可以用来确定有机反应中化学键的断裂位置 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com