
分析 根据n=$\frac{V}{{V}_{m}}$计算出标准状况下44.8L氮气的物质的量,从而可知含有N原子及含有质子的物质的量;然后根据N=nNA计算出含有氮原子和电子的数目.
解答 解:标准状况下44.8LN2的物质的量为:$\frac{44.8L}{22.4L/mol}$=2mol,2mol氮气分子中含有N原子的物质的量为:2mol×2=4mol,含有N原子数为4NA;4molN原子中含有质子的物质的量为:4mol×7=28mol,N原子中含有电子数=质子数=28NA,
故答案为:2;4;4NA;28;28NA.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与气体摩尔体积、阿伏伽德罗常数之间的关系即可解答,注意掌握原子与质子、电子之间的关系,试题培养了学生的化学计算能力.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②③⑤ | C. | ②④⑤ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 一 | ① | ||||||
| 二 | ② | ③ | ④ | ⑤ | ⑥ | ||
| 三 | ⑦ | ⑧ | ⑨ | ⑩ | |||
| 四 | (11) | (12) | (13) | ||||
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | C3H8中碳原子都采用的是sp3杂化 | |
| B. | O2、CO2、N2都是非极性分子 | |
| C. | 酸性:H2CO3<H3PO4<H2SO4<HClO | |
| D. | CO的一种等电子体为NO+,它的电子式为+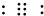 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠溶液与盐酸反应:Na2CO3+2H+═2Na++H2O+CO2↑ | |
| B. | 氧化铜与硫酸溶液反应:Cu2++2H+═Cu2++H2O | |
| C. | 锌与稀硫酸反应:Zn+2H+═Zn2++H2↑ | |
| D. | 硫酸铜溶液中放入铁片:3Cu2++2Fe═2Fe3++3Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2•8H2O与NH4Cl反应 | B. | 酸碱中和反应 | ||
| C. | 灼热的炭与CO2反应 | D. | H2与Cl2燃烧反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
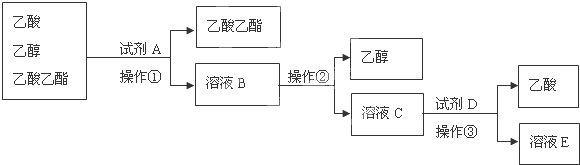
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ⑤⑥⑦⑧ | C. | ①③⑤⑥⑦⑧ | D. | ③④⑤⑥⑦⑧ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com