

分析 碱性乙醇电池为原电池,通入乙醇的电极是负极,通入氧气的电极是正极,乙池有外接电源,属于电解池,根据图片知,N是阳极,M是阴极,工作时M、N两个电极的质量都不减少,则M电极是铁,N电极是石墨,结合电子转移的物质的量的判断进行计算.
解答 解:碱性乙醇电池为原电池,通入乙醇的电极是负极,通入氧气的电极是正极,乙池有外接电源,属于电解池,根据图片知,N是阳极,M是阴极,工作时M、N两个电极的质量都不减少,则M电极是铁,N电极是石墨,
(1)通过以上分析知,M是阴极,N极是阳极,N上电极反应式为4OH--4e-=O2↑+2H2O,乙醇电极上乙醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为:C2H5OH-12e-+16OH-=2CO32-+11H2O,
故答案为:铁,4OH--4e-=O2↑+2H2O,C2H5OH-12e-+16OH-=2CO32-+11H2O;
(2)1g C2H5OH燃烧生成CO2和液态H2O时放出30kJ热量,则1mol乙醇燃烧放出的热量=$\frac{\frac{30kJ}{1g}}{46g/mol}$=1380kJ,所以其热化学反应方程式为:C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-1380kJ/mol,
故答案为:C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-1380kJ/mol;
(3)用石墨电极电解500mL含KNO3和Cu(NO3)2混合溶液,在两极均生成标准状况下的气体11.2L,气体的物质的量为n=$\frac{11.2L}{22.4L/mol}$=0.5mol,
溶液中阳离子放电顺序Cu2+>H+,阳极电极反应为溶液中阴离子氢氧根离子失电子生成氧气:4OH--4e-=2H2O+O2↑,生成0.5molO2,需电子为4×0.5mol=2mol;
阴极电极反应为:Cu2++2e-=Cu、2H++2e-=H2↑,生成0.5molH2,需0.5mol×2=1mol电子,依据电子守恒,铜离子得到电子1mol,反应的铜离子物质的量0.5mol,所以Cu2+的物质的量浓度C=$\frac{n}{V}$=$\frac{0.5mol}{0.5L}$=1mol/L,故答案为:1 mol/L.
点评 本题考查了电极原理的计算应用,注意电子守恒的计算应用和正确书写电极反应,题目难度中等.


科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 草酸二酯属于芳香族化合物 | |
| B. | 1mol草酸二酯最多可与4molNaOH反应 | |
| C. | 草酸二酯难溶于水 | |
| D. | 草酸二酯的分子式为C26H24O8Cl6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物可能含共价键 | B. | 共价化合物可能含离子键 | ||
| C. | 离子化合物中只含离子键 | D. | 共价化合物中只含离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
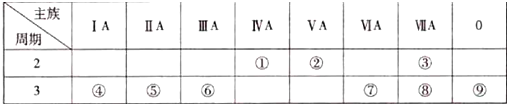
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
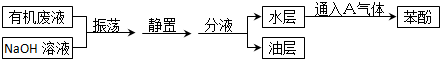
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com