(2011?江山市模拟)已知下图每一方框中的字母代表一种反应物或生成物(图中部分生成物没有列出).化合物A是由1828年德国化学家维勒通过蒸发氰酸铵得到的有机物,为此,他彻底打破了有机化合物只能由生物的细胞中提取的“生命力”论.A的化学式可表示为XY
4ZM
2,组成A的四种元素都是短周期元素,其原子序数之和为22,X、M、Z分别位于相邻的主族,原子序数依次增大.C、D、G、I、J、K为气体,其中C、K的温室效应均显著,K是含氢量最高的有机物,D能使湿润的红色石蕊试纸变蓝.B为一种白色固体,其最简式可表示为XY
2M
2,E的化学式可表示为X
3M
4.请按要求回答下列问题.
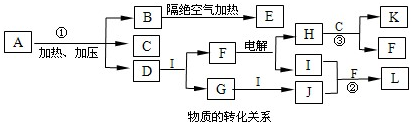
(1)A也是一种常用的肥料,其名称是
尿素或碳酰二胺或脲或碳酰胺
尿素或碳酰二胺或脲或碳酰胺
,目前工业上由
CO2
CO2
和
NH3
NH3
在一定条件而制得.
(2)反应①②③的化学方程式分别为
6(NH2)2CO→C3H6N6+NH3↑+3CO2↑
6(NH2)2CO→C3H6N6+NH3↑+3CO2↑
、
4NO2+O2+2H2O=4HNO3
4NO2+O2+2H2O=4HNO3
、
CO2+4H2→CH4+2H2
CO2+4H2→CH4+2H2
.
(3)I、B中M的质量分数为
66.7%
66.7%
;若B是一个含有叁键的分子,从结构上可看作是三分子(XY
2M
2)聚合而成,是一种低毒的化工原料,某些不法分子往奶粉里添加B而制造了闻名中外的“婴幼儿奶粉事件”,据此,请你画出B的结构简式
.
II、已知氨分子的键角为107°18′,下列关于B的说法不正确的是
④⑦⑩
④⑦⑩
.(填序号)
①含有不饱和碳原子,在一定条件下能发生加成反应
②能与盐酸反应生成盐
③在一定条件下能发生氧化反应
④分子中所有原子都在同一平面上
⑤在高温下分解放出N
2,故可用作阻燃剂
⑥在一定条件下可与氢气发生加成反应
⑦含氮量低于A的含氮量
⑧它是一种极性化合物,易溶于甲醇、甲醛等有机物
⑨大量食用含B污染奶粉的婴幼儿会产生肾结石等泌尿系统疾病
⑩是白色粉末,有刺激性气味
(4)化合物E是一种新型无机材料,它的一种结构(β-X
3M
4)具有可与金刚石相媲美的硬度.请推测该材料可能的用途之一是
做耐磨材料等
做耐磨材料等
.
(5)液态D类似H
2O,也能微弱电离且产生电子数相同的两种离子,则液态D电离方程式为
2NH
3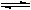
NH
4++NH
2-2NH
3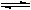
NH
4++NH
2-.
(6)①在结构上N
2H
4和D的关系有如H
2O
2和H
2O的关系.N
2H
4能发生下列反应:
N
2H
4+H
3O
+═N
2H
+5+H
2O N
2H
4+H
2O═N
2H
5++OH
-N
2H
5++H
2O═N
2H
62++OH
- N
2H
5++H
2O═N
2H
4+H
3O
+据此可得出的结论是
C
C
.
A.肼水解显酸性 B.肼在水中电离出H
+离子
C.肼是二元弱碱 D.肼是二元弱酸
②发射“神舟七号”飞船的长征2号火箭用了肼(N
2H
4)作燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水.已知4g N
2H
4(g)在上述反应中放出71kJ的热量,写出热化学方程式
N2H4(g)+NO2(g)=3/2N2(g)+2H2O(g);△H=-568kJ/mol.
N2H4(g)+NO2(g)=3/2N2(g)+2H2O(g);△H=-568kJ/mol.
.




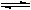 NH4++NH2-
NH4++NH2-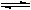 NH4++NH2-
NH4++NH2-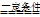 CO (NH2)2+H2O.再从NH3→G→J的变化均加入同一种物质I引起,故而判断出I为O2.进而推出F为H2O,H为H2,L为HNO3.推断物质为:A、CO (NH2)2;B、C3H6N6;C、CO2;D、NH3;F、H2O;G、NO;H、H2;I、O2;L、HNO3;J、NO2;K、CH4;依据判断出的各物质分析判断回答;
CO (NH2)2+H2O.再从NH3→G→J的变化均加入同一种物质I引起,故而判断出I为O2.进而推出F为H2O,H为H2,L为HNO3.推断物质为:A、CO (NH2)2;B、C3H6N6;C、CO2;D、NH3;F、H2O;G、NO;H、H2;I、O2;L、HNO3;J、NO2;K、CH4;依据判断出的各物质分析判断回答;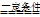 CO (NH2)2+H2O.再从NH3→G→J的变化均加入同一种物质I引起,故而判断出I为O2.进而推出F为H2O,H为H2,L为HNO3.推断物质为:A、CO (NH2)2;B、C3H6N6;C、CO2;D、NH3;F、H2O;G、NO;H、H2;I、O2;L、HNO3;J、NO2;K、CH4;
CO (NH2)2+H2O.再从NH3→G→J的变化均加入同一种物质I引起,故而判断出I为O2.进而推出F为H2O,H为H2,L为HNO3.推断物质为:A、CO (NH2)2;B、C3H6N6;C、CO2;D、NH3;F、H2O;G、NO;H、H2;I、O2;L、HNO3;J、NO2;K、CH4;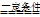 CO (NH2)2+H2O;
CO (NH2)2+H2O; ;
;
 H3O++OH-,通过类比不难得出液态NH3电离方程式为:2NH3
H3O++OH-,通过类比不难得出液态NH3电离方程式为:2NH3  NH4++NH2-. 故答案为:2NH3
NH4++NH2-. 故答案为:2NH3  NH4++NH2-;
NH4++NH2-;

 (2011?江山市模拟)碱性氢氧燃料电池工作时可产生过氧化氢(见图1),正极含碳(Carbon)的质量大小对产生过氧化氢的浓度(concentration)有影响(其影响曲线如图2所示).
(2011?江山市模拟)碱性氢氧燃料电池工作时可产生过氧化氢(见图1),正极含碳(Carbon)的质量大小对产生过氧化氢的浓度(concentration)有影响(其影响曲线如图2所示). (2)炉气精制的作用是将含SO2进行除法和水洗.而精制炉气即SO2的催化氧化,在接触室中进行.
(2)炉气精制的作用是将含SO2进行除法和水洗.而精制炉气即SO2的催化氧化,在接触室中进行.