
【题目】(1)实验室用浓硫酸制取氯化氢是因为它有_______性,用标况下收集的氯化氢做喷泉实验,若水只有充满烧瓶的![]() ,则所得溶液的物质的量浓度为_________mol/L;用排空气法收集的HCl气体对H2的相对密度为17,用同样的方法做喷泉实验,则水能够喷到整个烧瓶的_______。
,则所得溶液的物质的量浓度为_________mol/L;用排空气法收集的HCl气体对H2的相对密度为17,用同样的方法做喷泉实验,则水能够喷到整个烧瓶的_______。
(2)工业制氯化氢的原料来自于氯碱工业:电解饱和食盐水的化学反应方程式_______________,一段时间后,两极都有气体产生,在阴极附近滴加酚酞,溶液变___;同时阳极放出气体有刺激性气味,能使湿润碘化钾淀粉试纸变____。
【答案】难挥发性 ![]()
![]() 2NaCl+2H2O
2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑ 红 蓝
2NaOH+Cl2↑+H2↑ 红 蓝
【解析】
(1)由不挥发性酸制取挥发性酸的原理可知,实验室用不挥发性的浓硫酸与氯化钠固体反应制取氯化氢;设烧瓶的体积为V,若水只充满烧瓶的![]() 可知,烧瓶中氯化氢的体积为
可知,烧瓶中氯化氢的体积为![]() L,溶液的体积为
L,溶液的体积为![]() L,则所得盐酸溶液的物质的量浓度为
L,则所得盐酸溶液的物质的量浓度为![]() =
=![]() mol/L;用排空气法收集的HCl气体对H2的相对密度为17可知混合气体的相对分子质量为17×2=34,设混合气体中氯化氢的物质的量分数为x,混合气体的相对分子质量为34可得关系式36.5x+29(1-x)=34,解得x=
mol/L;用排空气法收集的HCl气体对H2的相对密度为17可知混合气体的相对分子质量为17×2=34,设混合气体中氯化氢的物质的量分数为x,混合气体的相对分子质量为34可得关系式36.5x+29(1-x)=34,解得x=![]() ,则氯化氢的体积为烧瓶体积的
,则氯化氢的体积为烧瓶体积的![]() ,由氯化氢气体体积等于进入烧瓶中水的体积可知,水能够喷到整个烧瓶的
,由氯化氢气体体积等于进入烧瓶中水的体积可知,水能够喷到整个烧瓶的![]() ,故答案为:难挥发性;
,故答案为:难挥发性;![]() ;
;![]() ;
;
(2)电解饱和食盐水得到氢氧化钠、氢气和氯气,反应的化学方程式为2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑;一段时间后,阴极上水得电子发生还原反应生成氢气和氢氧根,使阴极附近溶液显碱性,滴加酚酞溶液变红色,阳极上氯离子失电子发生氧化反应生成氯气,氯气与碘化钾溶液发生置换反应生成单质碘,单质碘淀粉溶液变蓝色,故答案为:2NaCl+2H2O
2NaOH+Cl2↑+H2↑;一段时间后,阴极上水得电子发生还原反应生成氢气和氢氧根,使阴极附近溶液显碱性,滴加酚酞溶液变红色,阳极上氯离子失电子发生氧化反应生成氯气,氯气与碘化钾溶液发生置换反应生成单质碘,单质碘淀粉溶液变蓝色,故答案为:2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑;红;蓝。
2NaOH+Cl2↑+H2↑;红;蓝。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖。现向一密闭容器中充入1mol N2和3mol H2,在一定条件下使该反应发生:N2+3H2![]() 2NH3。下列有关说法正确的是( )
2NH3。下列有关说法正确的是( )
A. 达到化学平衡时,正反应和逆反应的速率都为零
B. 当符合:3正N2=正H2时,反应达到平衡状态
C. 达到化学平衡时,单位时间消耗a molN2,同时生成3a molH2
D. 当N2、H2、NH3的分子数比为1∶3∶2,反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某芳香烃A可以从煤干馏得到的煤焦油中分离出来,以A为原料可以合成聚邻氨基苯甲酸、扁桃酸等物质,其合成流程如下(部分产物、合成路线、反应条件已略去):
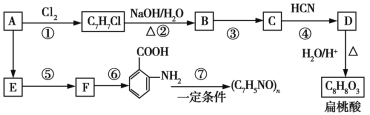
已知:
Ⅰ.R—CHO+HCN![]()
![]()
Ⅱ.R—CN![]() R—COOH
R—COOH
Ⅲ.![]()
![]()
![]() (苯胺易被氧化)
(苯胺易被氧化)
请回答下列问题:
(1)C的分子式为__________。
(2)下列对相关反应类型的判断合理的是__________ (填序号)。
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | |
Ⅰ | 加成 | 水解 | 还原 | 取代 | 还原 | 氧化 | 加聚 |
Ⅱ | 加成 | 消去 | 还原 | 加成 | 氧化 | 还原 | 缩聚 |
Ⅲ | 取代 | 水解 | 加成 | 氧化 | 还原 | 缩聚 | |
Ⅳ | 取代 | 消去 | 氧化 | 取代 | 还原 | 氧化 | 加聚 |
(3)写出反应③的化学方程式:______________________________。
(4)扁桃酸有多种同分异构体,其中既能与氯化铁溶液发生显色反应,又能与碳酸氢钠溶液反应产生气泡的同分异构体有__________种,写出其中一种的结构简式:__________________。
(5)以芳香烃A为主要原料,还可以通过下列合成路线合成阿司匹林和冬青油:

①冬青油的结构简式为____________________。
②写出反应Ⅴ的化学方程式:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4·xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务。
该组同学的研究课题是:探究测定草酸晶体(H2C2O4·xH2O)中的x值。通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:
2MnO![]() +5H2C2O4+6H+===2Mn2++10CO2↑+8H2O
+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O
学习小组的同学设计了如下步骤用滴定的方法测定x值。
①称取1.260 g纯草酸晶体,将其制成100.00 mL水溶液为待测液。
②取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4。
③用浓度为0.1000 mol·L-1的酸性KMnO4标准溶液进行滴定,达到终点时消耗10.00 mL。
(1)上述步骤②中使用的锥形瓶是否需要事先用待测液润洗_______。(填“是”或“否”)滴定时,将酸性KMnO4标准液装在如图中的________(填“甲”或“乙”)滴定管中。

(2)本实验滴定达到终点的标志可以是________________________________。
(3)通过上述数据,求得x=________。
讨论:①若滴定终点时俯视滴定管刻度,则由此测得的x值会________(填“偏大”、“偏小”或“不变”,下同)。
②根据上述实验计算的数据可信性不强,为了提高实验的准确性,请写出改进方法______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置能达到实验目的的是
选项 | A | B | C | D |
实验装置 |
|
|
|
|
实验目的 | 探究Na2CO3和NaHCO3溶解度的相对大小 | 用已知浓度的NaOH溶液滴定未知浓度的稀硫酸 | 检验蔗糖与浓硫酸反应产生的CO2 | 验证镁和稀盐酸的反应的热效应 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界中氟多以化合态形式存在,主要有萤石(CaF2)、冰晶石(Na3AlF6)等
(1)基态氟原子中,有_______种能量不同的电子。
(2)萤石(CaF2)难溶于水,但可溶于含Al3+的溶液中,原因是_________________(用离子方程式表示)。(已知AlF63-在溶液中可稳定存在)
(3)BF3与一定量的水形成(H2O)2BF3晶体Q,晶体Q在一定条件下可转化为R:

①晶体R中含有的化学键包括_________(填标号)。
A.离子键 B.配位键 C.共价键 D.氢键
②R中阳离子的空间构型为_________,阴离子中心原子的杂化方式为_________。
(4)F2与其他卤素单质反应可以形成卤素互化物,如ClF3、BrF3等。ClF3的熔沸点比BrF3的低,原因是___________________________________。
(5)Na3AlF6晶胞结构如图所示:

①位于大立方体体心▽代表________(填离子符号);
②AlF63-做面心立方最密堆积形成正四面体和正八面体两种空隙,正四面体空隙数和AlF63-数之比为_______,其中_________%正八面体空隙被Na+填充;
③晶胞边长为x nm,则相距最近的两个Na+之间距离为_____ nm;设Na3AlF6的相对分子质量为M,阿伏加德罗常数为NA,则该晶体密度的计算表达式为________g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示的装置,C、D、E、F、X、Y都是惰性电极。A、B为电源,将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色。则以下说法正确的是

A. 电源B极是正极
B. 欲用丙装置给铜镀银,H应该是Cu,电镀液是AgNO3溶液
C. 甲、乙装置的C、E电极均有单质生成,其物质的量之比为1:1
D. 装置丁电解一段时间后溶液的pH不变。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对有机物![]() 的叙述中,不正确的是( )
的叙述中,不正确的是( )
A. 它不能使溴水褪色,也不能使酸性KMnO4溶液褪色
B. 在FeBr3作催化剂时与Br2发生取代反应可生成三种一溴代物
C. 在一定条件下可发生加成反应
D. 一定条件下可以和浓硝酸、浓硫酸的混合物发生硝化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com