
【题目】为测定Na2SO3、Na2SO4混合样品ag中Na2SO3的质量分数,下列方案不合理的是
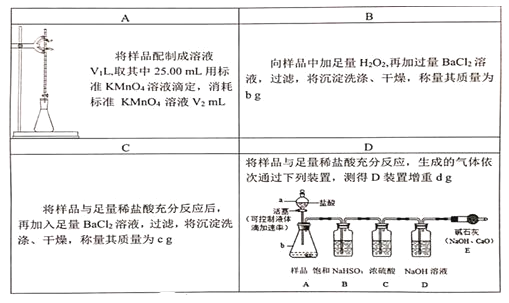
A. AB. BC. CD. D
【答案】A
【解析】
A. Na2SO3与KMnO4溶液发生氧化还原反应,可以通过KMnO4的量求出Na2SO3的量,但是只给出KMnO4的体积,未给出KMnO4溶液的浓度,无法求得Na2SO3的物质的量及其质量分数,A错误;
B.H2O2将Na2SO3氧化成Na2SO4,加足量BaCl2溶液将硫酸根沉淀得到BaSO4沉淀,根据沉淀的质量可以求得氧化后Na2SO4总物质的量,根据元素守恒及混合物样品质量,可得Na2SO3、Na2SO4的物质的量,可以求得Na2SO3的质量分数,B正确;
C.盐酸与Na2SO3反应,BaCl2与Na2SO4反应转化成BaSO4沉淀,求出Na2SO4的质量,根据样品总质量可求出Na2SO3的质量,最后求出Na2SO3的质量分数,C正确;
D. 盐酸与Na2SO3反应产生SO2气体,SO2气体中会混有杂质HCl,用饱和NaHSO3吸收HCl,再用浓硫酸干燥SO2气体后,通入NaOH溶液,测量增重质量dg,进一步计算出Na2SO3的质量分数,D正确;
故合理选项是A。


科目:高中化学 来源: 题型:
【题目】取碘水四份于试管中,编号为Ⅰ、Ⅱ、Ⅲ、Ⅳ,分别加入汽油、![]() 、酒精、NaCl溶液,振荡后静置,现象正确的是
、酒精、NaCl溶液,振荡后静置,现象正确的是![]()
![]()
A.Ⅰ中溶液分层,下层呈紫红色B.Ⅱ中溶液分层,下层呈紫红色
C.Ⅲ中溶液分层,下层呈黄褐色D.Ⅳ中溶液不分层,溶液由黄褐色变成黄绿色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某铜器表面Cux(OH)yClz(Cu为+2价,x、y、z为正整数)的组成,现进行如下实验:取少量Cux(OH)yClz,将其完全溶解于稀硝酸中,将所得溶液分成两等份。向其中一份滴加足量AgNO3溶液,将所得沉淀过滤、洗涤、干燥,得到固体0.1435 g。向另一份中加入0.1000 mol·L1 EDTA(已知Cu2+与EDTA反应的化学计量数比为1∶1),恰好完全反应时消耗EDTA 20mL。则Cux(OH)yClz的化学式中y的值为( )
A.1B.2C.3D.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据Mg能在CO2中燃烧,某兴趣小组推测Na应该也能在CO2中燃烧,且固体产物可能为C、Na2O和Na2CO3中的两种或三种。该小组用如下图装置进行了实验探究。已知PdCl2能被CO还原得到黑色的Pd。
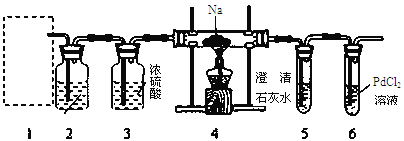
回答下列问题:
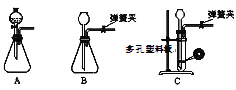
(1)为了使反应随开随用,随关随停,上图虚线方框内应选用____装置(填下图字母代号),如何检验所选装置的气密性_____。
(2)装置2中所盛试剂为_______。
A.NaOH溶液 B.饱和NaHCO3溶液
C.饱和Na2CO3溶液 D.饱和NaCl溶液
(3)检测装置的气密性完好并装好药品后,在点燃酒精灯前应先进行装置1中的反应操作,待观察到_____现象时,再点燃酒精灯,这步操作的目的是________。
(4)由实验现象和进一步的探究得出反应机理。
A.装置6中有黑色沉淀生成;
B.取反应后直玻管中的固体物质23.0g溶于足量的水中,无气泡产生且得到澄清的溶液;将溶液加水稀释配成250 mL的溶液;
C.取25.00ml步骤B的溶液,滴加足量BaCl2溶液,将生成的白色沉淀过滤、洗涤、干燥,称量得固体质量为1.97g。
①步骤C中不溶物干燥前必须经过洗涤,如何检验该沉淀是否洗涤干净____。
②该探究得出钠与二氧化碳反应的化学方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是( )
A.甲的分子数比乙的分子数多
B.甲的摩尔体积比乙的摩尔体积小
C.甲的相对分子质量比乙的相对分子质量小
D.甲的物质的量比乙的物质的量少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯水中含有多种成分,因而具有多种性质,根据新制氯水分别与如图四种物质发生的反应填空(a、b、c、d、e中重合部分代表物质间反应,且氯水足量)。
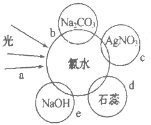
(1)能证明氯水具有漂白性的是___(填“a”“b”“c”或“d”);
(2)c过程中的现象是___;
(3)e过程中的化学方程式为___;
(4)实验室保存饱和氯水的方法是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)6.02×1023个氢氧根离子的物质的量是________mol,其摩尔质量为________。
(2)在标准状况下,0.01mol某气体的质量为0.44g,则该气体的密度为________g·L-1(保留小数点后两位),该气体的相对分子质量为________。
(3)将4g NaOH固体溶于水配成250mL溶液,此溶液中NaOH的物质的量浓度为______;取出10mL此溶液,将此10mL溶液加水稀释到100mL,稀释后溶液中NaOH的物质的量浓度为______。
(4)硫通常是一种淡黄色晶体,它的蒸气有橙色、无色、红棕色等多种,它们都是硫的单质,但是每个分子中硫原子的个数不同,可用Sx表示,对下列蒸气测定的结果是:无色蒸气的密度是同状况下氢气密度的64倍,则它的分子式为:______。
(5)把18.0mol/L的浓硫酸稀释成2.00mol/L的稀硫酸100mL,下列操作对所配溶液浓度造成的后果,属于“偏低”的是______________
①未洗涤稀释过浓硫酸的小烧杯;
②使用经蒸馏水洗涤后未干燥的小烧杯稀释浓硫酸;
③加水时不慎超过了刻度线,又将超出部分用吸管吸出;
④配溶液用的容量瓶用蒸馏水洗涤后未经干燥;
⑤定容时俯视刻度;
⑥倒转容量瓶摇匀后,液面降至刻度线下,再加水至刻度。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,A、B、C、D、E各代表碳、铁、二氧化碳、硫酸铜溶液、氢氧化钡溶液中的一种物质。一定条件下,相连环物质间能发生反应,不相连环物质间不能发生反应,且B的相对分子质量大于D。请填空:
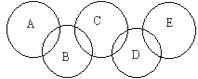
(1)写出下列物质的化学式:A_____,B_____,D_____。
(2)写出下列反应的离子方程式:B+C:_____________________。
(3)相连环物质间发生的反应中,氧化还原反应共有___________个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种三室微生物燃料电池污水净化系统原理如图所示,图中有机废水中有机物可用C6H10O5表示。下列有关说法正确的是:

A. b电极上发生氧化反应
B. b电极附近溶液的pH增大
C. a电极反应式:C6H10O5+24e-+7H2O===6CO2↑+24H+
D. 中间室:Na+移向左室,Cl-移向右室
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com