
【题目】(1)6.02×1023个氢氧根离子的物质的量是________mol,其摩尔质量为________。
(2)在标准状况下,0.01mol某气体的质量为0.44g,则该气体的密度为________g·L-1(保留小数点后两位),该气体的相对分子质量为________。
(3)将4g NaOH固体溶于水配成250mL溶液,此溶液中NaOH的物质的量浓度为______;取出10mL此溶液,将此10mL溶液加水稀释到100mL,稀释后溶液中NaOH的物质的量浓度为______。
(4)硫通常是一种淡黄色晶体,它的蒸气有橙色、无色、红棕色等多种,它们都是硫的单质,但是每个分子中硫原子的个数不同,可用Sx表示,对下列蒸气测定的结果是:无色蒸气的密度是同状况下氢气密度的64倍,则它的分子式为:______。
(5)把18.0mol/L的浓硫酸稀释成2.00mol/L的稀硫酸100mL,下列操作对所配溶液浓度造成的后果,属于“偏低”的是______________
①未洗涤稀释过浓硫酸的小烧杯;
②使用经蒸馏水洗涤后未干燥的小烧杯稀释浓硫酸;
③加水时不慎超过了刻度线,又将超出部分用吸管吸出;
④配溶液用的容量瓶用蒸馏水洗涤后未经干燥;
⑤定容时俯视刻度;
⑥倒转容量瓶摇匀后,液面降至刻度线下,再加水至刻度。
【答案】1 17g/mol 1.96 44 0.4mol/L 0.04mol/ L S4 ①③⑥
【解析】
(1)根据n=![]() 计算氢氧根离子的物质的量;摩尔质量以g/mol为单位,数值上等于其相对质量;
计算氢氧根离子的物质的量;摩尔质量以g/mol为单位,数值上等于其相对质量;
(2)根M=![]() 计算气体的摩尔质量,再根据ρ=
计算气体的摩尔质量,再根据ρ=![]() 计算气体的密度;摩尔质量以g/mol为单位,数值上等于其相对分子质量;
计算气体的密度;摩尔质量以g/mol为单位,数值上等于其相对分子质量;
(3)根据n=![]() 计算氢氧化钠的物质的量,再根据c=
计算氢氧化钠的物质的量,再根据c=![]() 计算溶液物质的量浓度;结合溶液的均一性和稀释后溶质的物质的量不变计算;
计算溶液物质的量浓度;结合溶液的均一性和稀释后溶质的物质的量不变计算;
(4)相同条件下,密度之比等于摩尔质量之比,据此计算Sx蒸气的摩尔质量,计算x值,写出分子式;
(5)根据c=![]() 并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析。
并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析。
(1)6.02×1023个氢氧根离子的物质的量是![]() =1mol,其摩尔质量为:17g/mol;
=1mol,其摩尔质量为:17g/mol;
(2)该气体的摩尔质量为![]() =44g/mol,故标况下该气体的密度为
=44g/mol,故标况下该气体的密度为![]() ≈1.96gL-1,该气体的相对分子质量为44;
≈1.96gL-1,该气体的相对分子质量为44;
(3)4g NaOH的物质的量为![]() =0.1mol,溶于水配成250mL溶液,此溶液中NaOH的物质的量浓度为
=0.1mol,溶于水配成250mL溶液,此溶液中NaOH的物质的量浓度为![]() =0.4mol/L;将该10mL溶液加水稀释到100mL,稀释后溶液中NaOH的物质的量浓度为
=0.4mol/L;将该10mL溶液加水稀释到100mL,稀释后溶液中NaOH的物质的量浓度为![]() =0.04mol/L;
=0.04mol/L;
(4)无色蒸气的密度是同状况下氢气密度的64倍,相同条件下,密度之比等于摩尔质量之比,所以SX蒸气的摩尔质量为2g/mol×64=128g/mol,所以32x=128,解得x=4,所以为S4;
(5)①未洗涤稀释过浓硫酸的小烧杯,会导致溶质的损失,则浓度偏低;
②使用经蒸馏水洗涤后未干燥的小烧杯稀释浓硫酸,对所配溶液的浓度无影响;
③加水时不慎超过了刻度线,又将超出部分用吸管吸出,则吸出的不止是水,还有溶质,故浓度偏低;
④配溶液用的容量瓶用蒸馏水洗涤后未经干燥,对所配溶液的浓度无影响;
⑤定容时俯视刻度,则溶液体积偏小,浓度偏高;
⑥倒转容量瓶摇匀后,液面降至刻度线下是正常的,再加水至刻度,则浓度偏低;
故答案为:①③⑥。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】纳米材料一直是人们研究的重要课题,例如纳米级Fe粉表面积大,具有超强的磁性,高效催化性等优良的性质。
I、实验室采用气相还原法制备纳米级Fe,其流程如图所示:

(1)纳米级Fe和稀盐酸反应的离子方程式为_______________________________。
(2)如何将FeCl2·nH2O固体加热脱水制得无水FeCl2 _____________________________________(用简要文字描述)。
(3)生成纳米级Fe的化学方程式为______________________________________。
II、查阅资料:在不同温度下,纳米级Fe粉与水蒸气反应的固体产物不同,温度低于570℃时生成FeO,高于570℃时生成Fe3O4。甲同学用如图甲装置所示进行纳米级Fe粉与水蒸气反应的实验,乙同学用图乙所示的装置进行纳米级Fe粉与水蒸气的反应并验证产物。
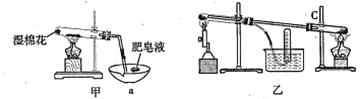
(4)甲装置中纳米级Fe粉与水蒸气反应的化学方程式是 ______________________。
(5)甲装置中仪器a的名称为_______________________。
(6)乙同学为探究实验结束后试管内的固体物质成分,进行了下列实验:
实验步骤 | 实验操作 | 实验现象 |
I | 将反应后得到的黑色粉末X(假定为均匀的),取出少量放入另一试管中,加入少量盐酸,微热 | 黑色粉末逐渐溶解,溶液呈浅绿色;有少量气泡产生 |
II | 向实验I得到的溶液中滴加几滴KSCN溶液,振荡 | 溶液没有出现红色 |
根据以上实验,乙同学认为该条件下反应的固体产物为FeO。
丙同学认为乙同学的结论不正确,他的理由是______(用简要文字描述)。
(7)丁同学称取5.60gFe粉,用乙装反应一段时间后,停止加热。将试管内的固体物质在干燥器中冷却后,称得质量为6.88g,则丁同学实验后的固体物质中氧化物的质量分数为________(结果保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿明洛芬属于苯丙氨酸类抗炎药。镇痛效果优于布洛芬。如图是阿明洛芬的一条合成路线。
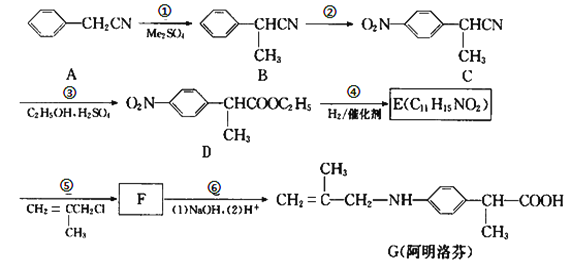
(1)反应①为取代反应,该步反应物Me2SO4中的“Me”表示___,D中官能团的名称是__。
(2)写出E的结构简式___。
(3)写出B到C这步反应的化学方程式___。
(4)G不能发生的反应类型是_____(填字母序号)。
A.水解反应 B.酯化反应 C.还原反应 D.加聚反应 E.缩聚反应
(5)写出F在NaOH溶液中反应的化学方程式_____。
(6)写出所有满足下列条件的B的同分异构体____。
①只含有一个环(即苯环)的芳香族化合物;
②核磁共振氢谱中氢峰的个数相比B的其它同分异构体最少。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是某同学对相应反应的离子方程式所作的评价,其中评价合理的是()
编号 | 化学反应 | 离子方程式 | 评价 |
| 碳酸钙与醋酸反应 |
| 错误,碳酸钙是弱电解质,不应写成离子形式 |
| 向 |
| 错误,碱过量,应生成 |
|
|
| 正确 |
| 等物质的量的 |
| 正确 |
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化锂(Li3N)常用作固体电解质和催化剂,遇水蒸气反应生成氢氧化锂和氨气,以一瓶氮气样品(含一氧化碳和氧气)制备纯净的氮化锂,其装置如图所示:
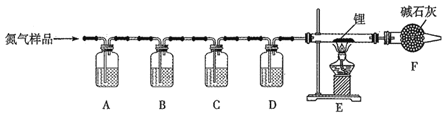
已知:连苯三酚的碱性溶液能吸收少量O2;氯化亚铜的盐酸溶液能吸收少量CO且易被O2氧化。请回答下列问题:
(1)选择下列试剂填入指定位置:
装置代号 | A | B | C | D |
试剂代号 | _____ | ______ | ____ | ____ |
![]() 浓硫酸
浓硫酸 ![]() 氯化亚铜的盐酸溶液
氯化亚铜的盐酸溶液
![]() 连苯三酚的碱性溶液
连苯三酚的碱性溶液 ![]() 氢氧化钠溶液
氢氧化钠溶液
(2)F装置的作用是______________。
(3)实验中,先通入氮气,后点燃酒精灯,目的是_____________。
(4)写出E中反应的化学方程式 ____________。
(5)设计如下装置测定产品纯度:称取a g产品于G烧瓶中,向安全漏斗中加入足量蒸馏水,收集到V mL气体(折合成标准状况)。

①安全漏斗的作用是______________________。
②H装置所装液体可能是________________![]() 填字母
填字母![]() 。
。
![]() 饱和氯化铵溶液
饱和氯化铵溶液 ![]() 煤油
煤油 ![]() 饱和食盐水
饱和食盐水 ![]() 苯
苯
③根据上述数据计算,该氮化锂产品纯度为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量是高中化学常用的物理量,请完成以下有关计算:
(1)3.4gNH3中含有________molH。
(2)标准状况下,等体积的CO和CO2的质量比为________。
(3)100mLAl2(SO4)3溶液中c(Al3+)=0.20molLˉ1,则c(SO42-)=_______。
(4)物质的量浓度相同的NaCl、MgCl2、AlCl3溶液中分别加入足量的AgNO3溶液中,生成沉淀的质量相等,三种溶液的体积比为____________。
(5)标准状况下VL氨气溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρg/mL,则该溶液的溶质的物质的量浓度为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各物质所含原子数由多到少的顺序是( )
①24 g碳 ②0.7 mol NH3 ③4.6 g钠 ④0.2 mol H2SO4 ⑤4 g He
A. ①③②④⑤B. ②①④⑤③
C. ②④①⑤③D. ④⑤②①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25 ℃时部分弱电解质的电离平衡常数如下表所示:
化学式 | CH3COOH | H2CO3 | HClO | |
平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
回答下列问题:
(1)物质的量浓度均为0.1 mol·L-1的四种溶液:
a. CH3COOH b. H2CO3 c. NaHCO3 d. HClO
pH由小到大的排列顺序是____(填字母)。
(2)常温下,0.1 mol·L-1CH3COOH溶液加水稀释过程中,下列表达式的数值变大的是____(填字母)。
A. c(H+) B.![]() C. c(H+)·c(OH-) D.
C. c(H+)·c(OH-) D.![]() E.
E.![]()
(3)体积均为100 mL、pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如下图所示,则HX的电离平衡常数____(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数,理由是____。在上述体积、pH均相同的CH3COOH与一元酸HX中加入足量的锌,生成的氢气在相同情况的体积大小关系为:CH3COOH____(填“大于”、“小于”或“等于”)HX

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com