
【题目】纳米材料一直是人们研究的重要课题,例如纳米级Fe粉表面积大,具有超强的磁性,高效催化性等优良的性质。
I、实验室采用气相还原法制备纳米级Fe,其流程如图所示:

(1)纳米级Fe和稀盐酸反应的离子方程式为_______________________________。
(2)如何将FeCl2·nH2O固体加热脱水制得无水FeCl2 _____________________________________(用简要文字描述)。
(3)生成纳米级Fe的化学方程式为______________________________________。
II、查阅资料:在不同温度下,纳米级Fe粉与水蒸气反应的固体产物不同,温度低于570℃时生成FeO,高于570℃时生成Fe3O4。甲同学用如图甲装置所示进行纳米级Fe粉与水蒸气反应的实验,乙同学用图乙所示的装置进行纳米级Fe粉与水蒸气的反应并验证产物。
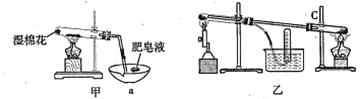
(4)甲装置中纳米级Fe粉与水蒸气反应的化学方程式是 ______________________。
(5)甲装置中仪器a的名称为_______________________。
(6)乙同学为探究实验结束后试管内的固体物质成分,进行了下列实验:
实验步骤 | 实验操作 | 实验现象 |
I | 将反应后得到的黑色粉末X(假定为均匀的),取出少量放入另一试管中,加入少量盐酸,微热 | 黑色粉末逐渐溶解,溶液呈浅绿色;有少量气泡产生 |
II | 向实验I得到的溶液中滴加几滴KSCN溶液,振荡 | 溶液没有出现红色 |
根据以上实验,乙同学认为该条件下反应的固体产物为FeO。
丙同学认为乙同学的结论不正确,他的理由是______(用简要文字描述)。
(7)丁同学称取5.60gFe粉,用乙装反应一段时间后,停止加热。将试管内的固体物质在干燥器中冷却后,称得质量为6.88g,则丁同学实验后的固体物质中氧化物的质量分数为________(结果保留三位有效数字)。
【答案】 Fe+2H+=Fe2++H2↑ 在干燥的HC1气流中加热 FeCl2+H2![]() Fe+2HCl Fe+H2O(g)
Fe+2HCl Fe+H2O(g)![]() FeO+H2 蒸发皿 加入KSCN溶液,溶液没有出现红色,也可能是因为Fe过量,与生成的Fe3+反应转化为Fe2+ 67.4%
FeO+H2 蒸发皿 加入KSCN溶液,溶液没有出现红色,也可能是因为Fe过量,与生成的Fe3+反应转化为Fe2+ 67.4%
【解析】(1)纳米级Fe和稀盐酸反应生成FeCl2和H2,离子方程式为Fe+2H+=Fe2++H2↑;
(2)FeCl2·nH2O固体加热脱水时,易发生水解,水解方程式为FeCl2+2H2O Fe(OH)2+2HCl,为防止FeCl2水解,在加热脱水时,通常通入干燥的HCl气体,HCl能抑制FeCl2的水解,且通入的HCl气体可带走水蒸气,利于固体脱水。故答案为:在干燥的HC1气流中加热;
(3)根据流程可知,FeCl2·nH2O固体加入脱水得到FeCl2,然后N2、H2与FeCl2在高温条件下反应得到纳米级Fe,反应方程式为FeCl2+H2![]() Fe+2HCl。
Fe+2HCl。
(4)根据已知“纳米级Fe粉与水蒸气反应,温度低于570℃时生成FeO”,甲装置用酒精灯加热,反应温度较低,产物为FeO。Fe失电子,水中H得电子,生成氢气,则反应方程式为Fe+H2O(g) ![]() FeO+H2;
FeO+H2;
(5)仪器a为蒸发皿;
(6)加入KSCN溶液,溶液没有出现红色,说明溶液中没有Fe3+,可能是因为纳米级Fe粉与水蒸气反应的过程中Fe过量,Fe没有反应完;将反应后的固体,加入少量的盐酸,也可能发生反应Fe+2 Fe3+=3Fe2+,所以看不到血红色。
故答案为:加入KSCN溶液,溶液没有出现红色,也可能是因为Fe过量,与生成的Fe3+反应转化为Fe2+;
(7)用乙装置反应,反应温度高于570℃,则Fe粉与水蒸气反应的固体产物为Fe3O4。反应后所得固体的质量为6.88g,其中氧原子的质量为m(O)=6.88g-5.60g=1.28g,则n(O)=![]() =0.08mol。由关系式1 Fe3O4~4 O,可得n(Fe3O4)=0.02mol。所以固体物质中氧化物的质量分数=
=0.08mol。由关系式1 Fe3O4~4 O,可得n(Fe3O4)=0.02mol。所以固体物质中氧化物的质量分数=![]() =
=![]() ≈67.4%
≈67.4%


 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:
【题目】下列电离方程式正确的是
A.K2CO3=K++CO32-B.NaOH=Na++O2-+H+
C.MgSO4=mg2++SO42-D.Ba(NO3) 2=Ba2++2NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值。下列有关叙述正确的是( )
A. 7.8gNa2O2中阴离子所含的电子数为1.8NA
B. 标准状况下,22.4LCCl4中所含C—C1键的数目为4NA
C. 在含Al3+总数为NA的AlCl3溶液中,Cl-总数为3NA
D. 在11P4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4反应中,6molCuSO4能氧化白磷的分子数为1.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据能量变化示意图,下列热化学方程式正确的是( )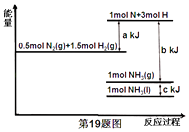
A.N2(g)+3H2(g)=2NH3(g)△H=﹣(b﹣a)kJmol﹣1
B.N2(g)+3H2(g)=2NH3(g)△H=﹣(a﹣b)kJmol﹣1
C.2NH3(l)=N2(g)+3H2(g)△H=2(a+b﹣c)kJmol﹣1
D.2NH3(l)=N2(g)+3H2(g)△H=2(b+c﹣a)kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铍铜是力学、化学综合性能良好的合金,广泛应用于制造高级弹性元件。以下是从某废旧铍铜元件(含BeO25%、CuS71%、少量FeS和SiO2)中回收铍和铜两种金属的流程

已知:I.铍、铝元素处于周期表中的对角线位置,化学性质相似
Ⅱ.常温下: Ksp[Cu(OH)2]=2.2×10-20 Ksp[Fe(OH)3]=4.0×10-38 K sp[Mn(OH)2]=2.1×10-13
(1)滤液A的主要成分除NaOH外,还有______________ (填化学式)
写出反应I中含铍化合物与过量盐酸反应的离子方程式____________________________
(2)①溶液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,选择合理步骤并排序______________。
a加入过量的 NaOH b.通入过量的CO2 c加入过量的氨水
d.加入适量的HCl e.过滤 f洗涤
②从BeCl2溶液中得到BeCl2固体的操作是____________________________。
(3)①MnO2能将金属硫化物中的硫元素氧化为单质硫,写出反应Ⅱ中CuS发生反应的化学方程式________________________________________________________。
②若用浓HNO3溶解金属硫化物,缺点是______________ (任写一条)。
(4)溶液D中含c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.008mol·L-1、c(Mn2+)=0.01mol·L-1,逐滴加入稀氨水调节pH可依次分离,首先沉淀的是______________ (填离子符号),为使铜离子开始沉淀,常温下应调节溶液的pH值大于______________。
(5)取铍铜元件1000g,最终获得Be的质量为81g,则产率是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某物质灼烧时,焰色反应为黄色,下列判断中正确的是( )
A.该物质一定是钠盐B.该物质一定含钠元素
C.可以确定该物质中一定不含钾元素D.该物质一定是金属钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
①江河入海口三角洲的形成通常与胶体的性质有关
②“钡餐”中使用的硫酸钡是弱电解质
③冰和干冰既是纯净物又是化合物
④雾是气溶胶,在阳光下可观察到丁达尔现象
⑤某无色溶液中加入稀盐酸,产生的气体可使澄清石灰水变浑浊,则原溶液中一定含CO![]()
⑥可用渗析法分离Fe(OH)3胶体和KCl溶液
A. ①③④⑤ B. ①③④⑥ C. ①③④⑤⑥ D. ①②③④⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com