
【题目】铍铜是力学、化学综合性能良好的合金,广泛应用于制造高级弹性元件。以下是从某废旧铍铜元件(含BeO25%、CuS71%、少量FeS和SiO2)中回收铍和铜两种金属的流程

已知:I.铍、铝元素处于周期表中的对角线位置,化学性质相似
Ⅱ.常温下: Ksp[Cu(OH)2]=2.2×10-20 Ksp[Fe(OH)3]=4.0×10-38 K sp[Mn(OH)2]=2.1×10-13
(1)滤液A的主要成分除NaOH外,还有______________ (填化学式)
写出反应I中含铍化合物与过量盐酸反应的离子方程式____________________________
(2)①溶液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,选择合理步骤并排序______________。
a加入过量的 NaOH b.通入过量的CO2 c加入过量的氨水
d.加入适量的HCl e.过滤 f洗涤
②从BeCl2溶液中得到BeCl2固体的操作是____________________________。
(3)①MnO2能将金属硫化物中的硫元素氧化为单质硫,写出反应Ⅱ中CuS发生反应的化学方程式________________________________________________________。
②若用浓HNO3溶解金属硫化物,缺点是______________ (任写一条)。
(4)溶液D中含c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.008mol·L-1、c(Mn2+)=0.01mol·L-1,逐滴加入稀氨水调节pH可依次分离,首先沉淀的是______________ (填离子符号),为使铜离子开始沉淀,常温下应调节溶液的pH值大于______________。
(5)取铍铜元件1000g,最终获得Be的质量为81g,则产率是______________。
【答案】 Na2SiO3、Na2BeO2 BeO22-+4H+=Be2++2H2O cefd 蒸发结晶时,向溶液中持续通入氯化氢气体 MnO2+CuS+2H2SO4=S↓+MnSO4+CuSO4+2H2O 产生污染环境的气体(合理即可) Fe3+ 4 90%
【解析】考查化学工艺流程,(1)旧铍铜原件的成分BeO、CuS、FeS、SiO2,根据信息I,BeO属于两性氧化物,CuS不与氢氧化钠溶液反应,FeS不与氢氧化钠反应,SiO2属于酸性氧化物,能与氢氧化钠溶液反应,因此滤液A中主要成分是NaOH、Na2SiO3、Na2BeO2;根据信息I,BeO2-与过量盐酸反应的离子方程式为 BeO22-+4H+=Be2++2H2O;(2)利用Be元素、铝元素化学性质相似,向溶液C中先加入过量的氨水,生成Be(OH)2沉淀,然后过滤、洗涤,再加入适量的HCl,生成BeCl2,合理步骤是cefd;②为了抑制Be2+的水解,因此需要在HCl的氛围中对BeCl2溶液蒸发结晶;(3)①根据信息,CuS中S转化为S单质,MnO2中Mn被还原为Mn2+,根据化合价升降法进行配平,其化学反应方程式为MnO2+CuS+2H2SO4=S↓+MnSO4+CuSO4+2H2O ;②用浓硝酸作氧化剂,HNO3被还原成NO2,NO2有毒污染环境;(4)三种金属阳离子出现沉淀,根据浓度商与Ksp的关系,Cu2+转化成沉淀,c(OH-)=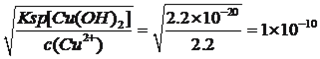 mol·L-1,Fe3+转化成沉淀,c(OH-)=
mol·L-1,Fe3+转化成沉淀,c(OH-)=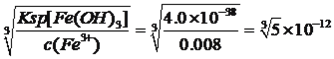 mol·L-1,Mn2+转化成沉淀,c(OH-)=
mol·L-1,Mn2+转化成沉淀,c(OH-)=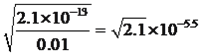 mol·L-1,因此首先沉淀的是Fe3+,为使Cu2+沉淀,此时c(OH-)=1×10-10mol·L-1,c(H+)=10-14/10-10=10-4mol·L-1,即pH=4,当pH>4时,Cu2+出现沉淀;(5)混合物中BeO的质量为1000×25%=250g,理论上得到Be的物质的量为250/25mol=10mol,实际得到Be物质的量为81/9mol=9mol,产率是9/10×100%=90%。
mol·L-1,因此首先沉淀的是Fe3+,为使Cu2+沉淀,此时c(OH-)=1×10-10mol·L-1,c(H+)=10-14/10-10=10-4mol·L-1,即pH=4,当pH>4时,Cu2+出现沉淀;(5)混合物中BeO的质量为1000×25%=250g,理论上得到Be的物质的量为250/25mol=10mol,实际得到Be物质的量为81/9mol=9mol,产率是9/10×100%=90%。


科目:高中化学 来源: 题型:
【题目】向0.1molL-1的H2SO4溶液中滴入0.1molL-1过量的Ba(OH)2溶液,溶液的导电能力发生变化,其电流强度(I)随加入Ba(OH)2溶液的体积(V)的变化曲线正确的是
A.
B.
C.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)常温下,0.1mol/L 的CH3COOH溶液中有1%的CH3COOH分子发生电离,则溶液的pH=;可以使0.10 mol·L-1 CH3COOH的电离程度增大的是
a.加入少量0.10 mol·L-1的稀盐酸
b.加热CH3COOH溶液
c.加水稀释至0.010 mol·L-1
d.加入少量冰醋酸
e.加入少量氯化钠固体
f.加入少量0.10 mol·L-1的NaOH溶液
(2)将等质量的锌投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸)V(醋酸)(填“>”、“<”或“=”)。
(3)0.1mol/L的某酸H2A的pH=4,则H2A的电离方程式为。
(4)25℃时,将pH=9的NaOH溶液与pH=4的盐酸溶液混合,若所得混合溶液的pH=6,则NaOH溶液与盐酸溶液的体积比为。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米材料一直是人们研究的重要课题,例如纳米级Fe粉表面积大,具有超强的磁性,高效催化性等优良的性质。
I、实验室采用气相还原法制备纳米级Fe,其流程如图所示:

(1)纳米级Fe和稀盐酸反应的离子方程式为_______________________________。
(2)如何将FeCl2·nH2O固体加热脱水制得无水FeCl2 _____________________________________(用简要文字描述)。
(3)生成纳米级Fe的化学方程式为______________________________________。
II、查阅资料:在不同温度下,纳米级Fe粉与水蒸气反应的固体产物不同,温度低于570℃时生成FeO,高于570℃时生成Fe3O4。甲同学用如图甲装置所示进行纳米级Fe粉与水蒸气反应的实验,乙同学用图乙所示的装置进行纳米级Fe粉与水蒸气的反应并验证产物。
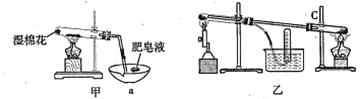
(4)甲装置中纳米级Fe粉与水蒸气反应的化学方程式是 ______________________。
(5)甲装置中仪器a的名称为_______________________。
(6)乙同学为探究实验结束后试管内的固体物质成分,进行了下列实验:
实验步骤 | 实验操作 | 实验现象 |
I | 将反应后得到的黑色粉末X(假定为均匀的),取出少量放入另一试管中,加入少量盐酸,微热 | 黑色粉末逐渐溶解,溶液呈浅绿色;有少量气泡产生 |
II | 向实验I得到的溶液中滴加几滴KSCN溶液,振荡 | 溶液没有出现红色 |
根据以上实验,乙同学认为该条件下反应的固体产物为FeO。
丙同学认为乙同学的结论不正确,他的理由是______(用简要文字描述)。
(7)丁同学称取5.60gFe粉,用乙装反应一段时间后,停止加热。将试管内的固体物质在干燥器中冷却后,称得质量为6.88g,则丁同学实验后的固体物质中氧化物的质量分数为________(结果保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语对事实的表述不正确的是( )
A. 氢氧化钠溶液与二氧化硅反应:SiO2+2OH-=SiO32-+H2O
B. 常温时,0.1mol·L-1氨水的pH=11.1:NH3·H2O![]() NH4++OH-
NH4++OH-
C. 由Na和Cl形成离子键的过程: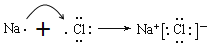
D. 大理石与醋酸反应CO32-+2CH3COOH=2CH3COO-+H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。

下列说法不正确的是( )
A. 生成CH3COOH总反应的原子利用率为100%
B. CH4+CO2→CH3COOH过程中,只有C-H键发生断裂
C. ①→②放出能量并形成了C-C键
D. 催化剂加快了该反应的速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10 molL-1 NaOH溶液滴定20.00mL 0.10molL-1的CH3COOH溶液,所得滴定曲线如图。下列说法正确的是
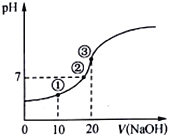
A. 点①所示溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B. 点②所示溶液中:c(Na+)=c(CH3COO-),酸碱恰好完全反应
C. 点③所示溶液中:c(OH-)-(H+)=c(CH3COOH)
D. 滴定过程中:c(CH3COO-)+c(CH3COOH)= 0.10molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-12.某溶液中含有Cl-、Br-和CrO42-浓度均为0.010mol.L-1,向该溶液中逐滴加入0.010mol.L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为( )
A. Cl-、Br-、CrO42- B. CrO42-、Br-、Cl-
C. Br-、Cl-、CrO42- D. Br-、CrO42-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一点条件下,RO3n-+F2+aOH-=RO4- +2F-+H2O,下列叙述正确的是( )
A.n=2,a=2B.n=2,a=1
C.RO3n-中R的化合价为+6D.n=1,a=2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com