
【题目】常温下,用0.10 molL-1 NaOH溶液滴定20.00mL 0.10molL-1的CH3COOH溶液,所得滴定曲线如图。下列说法正确的是
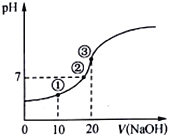
A. 点①所示溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B. 点②所示溶液中:c(Na+)=c(CH3COO-),酸碱恰好完全反应
C. 点③所示溶液中:c(OH-)-(H+)=c(CH3COOH)
D. 滴定过程中:c(CH3COO-)+c(CH3COOH)= 0.10molL-1
【答案】C
【解析】A、点①反应后溶液是CH3COONa与CH3COOH物质的量之比为1:1的混合物,CH3COOH电离程度大于CH3COO-的水解程度,故c(Na+)<c(CH3COOH),故A错误;B、点②pH=7,即c(H+)=c(OH-),由电荷守恒知:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故c(Na+)=c(CH3COO-),若酸碱恰好完全反应则刚好生成CH3COONa,CH3COONa水解显碱性,所以酸碱不可能恰好完全反应,故B错误; C、点③说明两溶液恰好完全反应生成CH3COONa,由电荷守恒知:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),由物料守恒可知c(CH3COO-)+ c(CH3COOH)= c(Na+),电荷守恒和物料守恒相结合可得 c(OH-)-(H+)=c(CH3COOH),故C正确;D.滴定过程中:c(CH3COO-)+c(CH3COOH) < 0.10molL-1故D错误;答案选C.


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
【题目】党的十九大报告中提出加快生态文明体制改革,建设美丽中国,坚持人与自然和谐共生。下列有关观念或做法不宜提倡的是
A. 青山绿水就是金山银山 B. 创建环境友好型社会人人有责
C. 大力开发森林资源,发展乡村旅游 D. 积极做好治沙工作,做到人进沙退
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据能量变化示意图,下列热化学方程式正确的是( )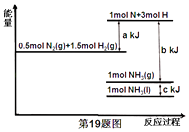
A.N2(g)+3H2(g)=2NH3(g)△H=﹣(b﹣a)kJmol﹣1
B.N2(g)+3H2(g)=2NH3(g)△H=﹣(a﹣b)kJmol﹣1
C.2NH3(l)=N2(g)+3H2(g)△H=2(a+b﹣c)kJmol﹣1
D.2NH3(l)=N2(g)+3H2(g)△H=2(b+c﹣a)kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铍铜是力学、化学综合性能良好的合金,广泛应用于制造高级弹性元件。以下是从某废旧铍铜元件(含BeO25%、CuS71%、少量FeS和SiO2)中回收铍和铜两种金属的流程

已知:I.铍、铝元素处于周期表中的对角线位置,化学性质相似
Ⅱ.常温下: Ksp[Cu(OH)2]=2.2×10-20 Ksp[Fe(OH)3]=4.0×10-38 K sp[Mn(OH)2]=2.1×10-13
(1)滤液A的主要成分除NaOH外,还有______________ (填化学式)
写出反应I中含铍化合物与过量盐酸反应的离子方程式____________________________
(2)①溶液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,选择合理步骤并排序______________。
a加入过量的 NaOH b.通入过量的CO2 c加入过量的氨水
d.加入适量的HCl e.过滤 f洗涤
②从BeCl2溶液中得到BeCl2固体的操作是____________________________。
(3)①MnO2能将金属硫化物中的硫元素氧化为单质硫,写出反应Ⅱ中CuS发生反应的化学方程式________________________________________________________。
②若用浓HNO3溶解金属硫化物,缺点是______________ (任写一条)。
(4)溶液D中含c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.008mol·L-1、c(Mn2+)=0.01mol·L-1,逐滴加入稀氨水调节pH可依次分离,首先沉淀的是______________ (填离子符号),为使铜离子开始沉淀,常温下应调节溶液的pH值大于______________。
(5)取铍铜元件1000g,最终获得Be的质量为81g,则产率是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用浓氨水检查氯气管道是否泄漏,发生反应为:8NH3 +3C12=N2+6NH4C1, 该反应属于
A. 置换反应 B. 分解反应 C. 化合反应 D. 复分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某物质灼烧时,焰色反应为黄色,下列判断中正确的是( )
A.该物质一定是钠盐B.该物质一定含钠元素
C.可以确定该物质中一定不含钾元素D.该物质一定是金属钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气是一种重要的化工原料,可用来生产氢气和甲醇等高附加值化学品。回答下列问题:
(1)以天然气为原料制取氢气是工业上常用的制氢方法。
已知:
①CH4(g)+H2O(g) =CO(g)+3H2(g) ΔH1=a kJ·mol-1
②CH4(g)+CO2(g) =2CO(g)+2H2(g) ΔH2=b kJ·mol-1
③CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH3
请计算上述反应中的反应热ΔH3=_________(用a、b表示)kJ·mol-1。
(2)合成甲醇的反应原理为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) 在1L的密闭容器中,充入1mol CO2和3 mol H2,在500℃下发生反应,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) 在1L的密闭容器中,充入1mol CO2和3 mol H2,在500℃下发生反应,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
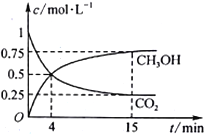
①反应进行到4 min 时,v(正)____ (填“>”“<”或“=”)v(逆)。0~4 min,CO2的平均反应速率v(CO2)=____________mol·L-1·min-1。
②CO2的平衡转化率为_______________,该温度下平衡常数为_____________。
③下列能说明该反应已达到平衡状态的是______________。
a.v正(CH3OH)=3v逆(H2)
b.CO2、H2、CH3OH和H2O浓度之比为1: 3 :1: 1
C.恒温恒压下,气体的体积不再变化
d.恒温恒容下,气体的密度不再变化
(3)在相同温度、相同容积的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器 | 容器1 | 容器2 | 容器3 |
反应物投入量 | 1mol CO2,3 mol H2 | 0.5mol CO2,1.5mol H2 | 1mol CH3OH,1mol H2O |
CH3OH的平衡浓度/mol·L-1 | c1 | c1 | c3 |
平衡时体系压强/Pa | p1 | p2 | p3 |
则下列各量的大小关系为c1_________(填“>”“<”或“=”,下同)c3,p2________p3。
(4)为提高燃料的能量利用率,常将其设计为燃料电池。某电池以甲烷为燃料,空气为氧化剂,熔融的K2CO3为电解质,以具有催化作用和导电性能的稀土金属为电极。写出该燃料电池的负极反应式:__________________________;为使电解质的组成保持稳定,使该燃料电池长时间稳定运行,在通入的空气中必须加入________________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用压强传感器探究生铁在pH=2和pH=4醋酸溶液中发生腐蚀的装置及得到的图象如下:分析图象,以下结论错误的是( )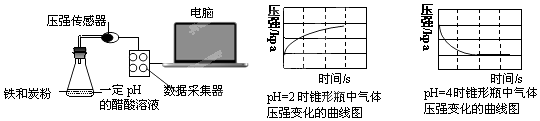
A.溶液pH≤2时,生铁发生析氢腐蚀
B.生铁的腐蚀中化学腐蚀比电化学腐蚀更普遍
C.在酸性溶液中生铁可能发生吸氧腐蚀
D.两溶液中负极反应均为:Fe﹣2e﹣═Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe3+、SO42-、Mg2+、和X四种离子以物质的量之比2∶3∶2∶4大量共存于同一种溶液中,X可能是( )
A.NH4+B.OH-C.CO32-D.Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com