
����Ŀ����Ȼ����һ����Ҫ�Ļ���ԭ�ϣ����������������ͼ״��ȸ߸���ֵ��ѧƷ���ش��������⣺
��1������Ȼ��Ϊԭ����ȡ�����ǹ�ҵ�ϳ��õ����ⷽ����
��֪��
��CH4(g)+H2O(g) =CO(g)+3H2(g) ��H1��a kJ��mol-1
��CH4(g)+CO2(g) =2CO(g)+2H2(g) ��H2��b kJ��mol-1
��CH4(g)+2H2O(g)=CO2(g)+4H2(g) ��H3
�����������Ӧ�еķ�Ӧ�Ȧ�H3=_________����a��b��ʾ��kJ��mol-1��
��2���ϳɼ״��ķ�Ӧԭ��Ϊ��CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ��1L���ܱ������У�����1mol CO2��3 mol H2����500���·�����Ӧ�����CO2(g)��CH3OH(g)��Ũ����ʱ��仯��ͼ��ʾ��
CH3OH(g)+H2O(g) ��1L���ܱ������У�����1mol CO2��3 mol H2����500���·�����Ӧ�����CO2(g)��CH3OH(g)��Ũ����ʱ��仯��ͼ��ʾ��
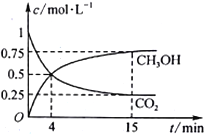
�ٷ�Ӧ���е�4 min ʱ��v(��)____ ���>����<����=����v(��)��0~4 min��CO2��ƽ����Ӧ����v(CO2)=____________mol��L-1��min-1��
��CO2��ƽ��ת����Ϊ_______________�����¶���ƽ�ⳣ��Ϊ_____________��
��������˵���÷�Ӧ�Ѵﵽƽ��״̬����______________��
a.v��(CH3OH)=3v��(H2)
b.CO2��H2��CH3OH��H2OŨ��֮��Ϊ1: 3 :1: 1
C.���º�ѹ�£������������ٱ仯
d.���º����£�������ܶȲ��ٱ仯
��3������ͬ�¶ȡ���ͬ�ݻ���3���ܱ������У�����ͬ��ʽͶ�뷴Ӧ����ֺ��¡����ݣ���÷�Ӧ�ﵽƽ��ʱ���й��������£�
���� | ����1 | ����2 | ����3 |
��Ӧ��Ͷ���� | 1mol CO2��3 mol H2 | 0.5mol CO2��1.5mol H2 | 1mol CH3OH��1mol H2O |
CH3OH��ƽ��Ũ��/mol��L-1 | c1 | c1 | c3 |
ƽ��ʱ��ϵѹǿ/Pa | p1 | p2 | p3 |
�����и����Ĵ�С��ϵΪc1_________���>����<����=������ͬ��c3��p2________p3��
��4��Ϊ���ȼ�ϵ����������ʣ����������Ϊȼ�ϵ�ء�ij����Լ���Ϊȼ�ϣ�����Ϊ�����������ڵ�K2CO3Ϊ����ʣ��Ծ��д����ú͵������ܵ�ϡ������Ϊ�缫��д����ȼ�ϵ�صĸ�����Ӧʽ��__________________________��Ϊʹ����ʵ���ɱ����ȶ���ʹ��ȼ�ϵ�س�ʱ���ȶ����У���ͨ��Ŀ����б������________________���ѧʽ����
���𰸡� 2a-b > 0.125 75% 5.33��![]() c = < CH4-8e-+4CO32-=5CO2+2H2O CO2
c = < CH4-8e-+4CO32-=5CO2+2H2O CO2
����������1�����ݸ�˹���ɿɵâ�=��![]() -�ڣ����Ԧ�H3=2��H1-��H2=��2a-b��kJ��mol-1����Ϊ��2a-b
-�ڣ����Ԧ�H3=2��H1-��H2=��2a-b��kJ��mol-1����Ϊ��2a-b
��2���ٷ�Ӧ���е�4 min ʱCH3OH��CO2��Ũ����ȣ�����Ӧδ�ﵽƽ��״̬������������Ӧ������У����v(��) >v(��)��0~4 minʱ��v(CO2)=![]() =0.125 mol��L-1��min-1
=0.125 mol��L-1��min-1
������ͼ���֪CO2��ƽ��ת���ʣ�![]() ��100%��75%�����¶���ƽ�ⳣ��ΪK=
��100%��75%�����¶���ƽ�ⳣ��ΪK=![]() =
=![]() =
=![]() mol-2��L2��5.33 mol-2��L2
mol-2��L2��5.33 mol-2��L2
��a.��Ӧ����֮�ȵ��ڻ�ѧ����ʽ������֮�������3v��(CH3OH)=v��(H2)������v��(CH3OH)=3v��(H2)����˵��CH3OH���淴Ӧ������ͬ��a����b.ƽ��ʱ��Ӧ������и���ֵĺ������ֲ��䣬��������CO2��H2��CH3OH��H2O��Ũ��֮�Ȳ�һ��Ϊ1: 3 :1: 1�����Բ�����Ϊƽ��ı�־��b����C.�÷�Ӧ������������仯�ķ�Ӧ�����º�ѹ�£������������ٱ仯��������Ϊƽ��ı�־��c��ȷ��d. ��Ӧǰ��������������䣬������������䣬�����ܶ�ʼ�ձ��ֲ��䣬��˻��������ܶȱ��ֲ��䲻����Ϊƽ��ı�־��d����Ϊ����0.125��75% ��5.33��![]() ��c
��c
��3�����ݷ���ʽ������һ�ߵ��ķ�����֪��1molCH3OH��1molH2O��ȫת��Ϊ��Ӧ�����1molCO2��3molH2���������1������3�ǵ�Чƽ�⣬����ƽ��ʱ�״���Ũ��c1����c3������2�൱��������1�Ļ����ϼ�Сѹǿ��ƽ�����淴Ӧ�����ƶ�����ƽ��ʱp2С��p3��Ϊ�� = ��<
��4������ȼ�ϵ���Լ���Ϊȼ�ϣ��Կ���Ϊ�������������ڵ�K2CO3Ϊ����ʣ���ظ�����ӦΪ��CH4-8e-+4CO32-=5CO2+2H2O��������ӦΪO2+4e-+2CO2=2CO32-���ܷ�ӦΪCH4+2O2=CO2+2H2O������ͨ�������һ���ǵ�Դ�����������������Ķ�����̼��Ϊʹ����ʵ���ɱ����ȶ���ʹ��ȼ�ϵ�س�ʱ���ȶ����У���ͨ��Ŀ����б������CO2����Ϊ��CH4-8e-+4CO32-=5CO2+2H2O ��CO2



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ����(Ru)����������Ⱦ������̫���ܵ�صĹ���ԭ��������з�������Ҫ��Ӧ��ͼ��ʾ������˵���������
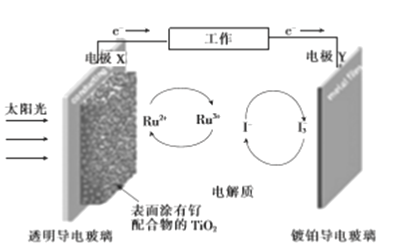
A. ��ع���ʱ������ת��Ϊ���ܣ�XΪ��صĸ���
B. �Ʋ����粣���Ϸ���������Ӧ����I-
C. �������Һ�з�����Ӧ:2Ru3++3I-![]() 2Ru2++I3-
2Ru2++I3-
D. ��ع���ʱ���������Һ��I-��I3-��Ũ�Ȼ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ�������ʵ�ı�������ȷ���ǣ� ��
A. ����������Һ��������跴Ӧ��SiO2+2OH-��SiO32-+H2O
B. ����ʱ��0.1mol��L-1��ˮ��pH=11.1��NH3��H2O![]() NH4++OH-
NH4++OH-
C. ��Na��Cl�γ����Ӽ��Ĺ��̣�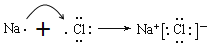
D. ����ʯ����ᷴӦCO32-+2CH3COOH=2CH3COO-+H2O+CO2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0.10 molL-1 NaOH��Һ�ζ�20.00mL 0.10molL-1��CH3COOH��Һ�����õζ�������ͼ������˵����ȷ����
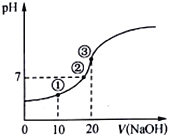
A. �����ʾ��Һ�У�c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B. �����ʾ��Һ�У�c(Na+)=c(CH3COO-)�����ǡ����ȫ��Ӧ
C. �����ʾ��Һ�У�c(OH-)-(H+)=c(CH3COOH)
D. �ζ������У�c(CH3COO-)+c(CH3COOH)= 0.10molL-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ������ȤС��Ϊ̽��NO�����ױ��������������۲�NO�����ʵ����ɫ��ͬʱΪ�˷�ֹ������ɢ��Ⱦ��������ʵ������ȡNO�����װ�ø�װ���£�
��ֹˮ�Т�©��������ϡ���ᣬֱ��Һ���ûͭ˿�����Թ�A��������ƽ��ʱ���ر�ֹˮ�Т��þƾ������Թ�A��
��1������ϡ�������Թ�A��������ƽ���Ŀ���� ��
��2�����þƾ������Թ�Aʱ��A�з�Ӧ�ӿ죬��д����Ӧ����ʽ ��
��3��������B�Թܵ�Һ��û��ͭ˿������B�Թܣ���ʱB�Թ����ܹ۲쵽�������� ��
��4��Ϊ�˷�ֹ������Ⱦ������C�ձ���Ӧװ����Һ��
A.NaOH ��Һ
B.CuSO4��Һ
C.NaCl��Һ
D.AgNO3��Һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪Ksp��AgCl��=1.56��10-10��Ksp��AgBr��=7.7��10-13��Ksp��Ag2CrO4��=9.0��10-12��ij��Һ�к���Cl-��Br-��CrO42-Ũ�Ⱦ�Ϊ0.010mol.L-1�������Һ����μ���0.010mol.L-1��AgNO3��Һʱ�����������Ӳ����������Ⱥ�˳��Ϊ��������
A. Cl-��Br-��CrO42- B. CrO42-��Br-��Cl-
C. Br-��Cl-��CrO42- D. Br-��CrO42-��Cl-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������εĻ����Һ�к���0.2molNa+ �� 0.25molMg2+ �� 0.4molCl�� �� ��SO42�������ʵ���Ϊ�� ��
A.0.1 mol
B.0.3 mol
C.0.5 mol
D.0.15 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й����ʵ����ʺ�Ӧ�ö�Ӧ��ϵ��ȷ����
A. ������۵�ߡ�Ӳ�ȴ�������̫���ܵ�غͼ����оƬ����Ҫ����
B. �������۵�ߣ����������²���
C. ��������ˮ���γɽ��壬����������ˮ��ɱ������
D. �մ���Һ�������ԣ�������θ���кͼ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ӽ���ķ�����ȷ����
A. ij��Һ![]() ������ɫ���壬˵��ԭ��Һ����CO32-
������ɫ���壬˵��ԭ��Һ����CO32-
B. ij��Һ![]() ��Һ��ΪѪ��ɫ��˵��ԭ��Һ����Fe2+
��Һ��ΪѪ��ɫ��˵��ԭ��Һ����Fe2+
C. ij��Һ![]() �а�ɫ������˵��ԭ��Һ����SO42-
�а�ɫ������˵��ԭ��Һ����SO42-
D. ij��Һ![]() ����ʹʪ��ĺ�ɫʯ����ֽ���������壬˵��ԭ��Һ����NH4+
����ʹʪ��ĺ�ɫʯ����ֽ���������壬˵��ԭ��Һ����NH4+
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com