
【题目】下列离子检验的方法正确的是
A. 某溶液![]() 生成无色气体,说明原溶液中有CO32-
生成无色气体,说明原溶液中有CO32-
B. 某溶液![]() 溶液变为血红色,说明原溶液中有Fe2+
溶液变为血红色,说明原溶液中有Fe2+
C. 某溶液![]() 有白色沉淀,说明原溶液中有SO42-
有白色沉淀,说明原溶液中有SO42-
D. 某溶液![]() 产生使湿润的红色石蕊试纸变蓝的气体,说明原溶液中有NH4+
产生使湿润的红色石蕊试纸变蓝的气体,说明原溶液中有NH4+
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】天然气是一种重要的化工原料,可用来生产氢气和甲醇等高附加值化学品。回答下列问题:
(1)以天然气为原料制取氢气是工业上常用的制氢方法。
已知:
①CH4(g)+H2O(g) =CO(g)+3H2(g) ΔH1=a kJ·mol-1
②CH4(g)+CO2(g) =2CO(g)+2H2(g) ΔH2=b kJ·mol-1
③CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH3
请计算上述反应中的反应热ΔH3=_________(用a、b表示)kJ·mol-1。
(2)合成甲醇的反应原理为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) 在1L的密闭容器中,充入1mol CO2和3 mol H2,在500℃下发生反应,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) 在1L的密闭容器中,充入1mol CO2和3 mol H2,在500℃下发生反应,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
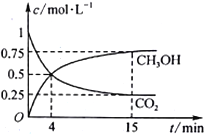
①反应进行到4 min 时,v(正)____ (填“>”“<”或“=”)v(逆)。0~4 min,CO2的平均反应速率v(CO2)=____________mol·L-1·min-1。
②CO2的平衡转化率为_______________,该温度下平衡常数为_____________。
③下列能说明该反应已达到平衡状态的是______________。
a.v正(CH3OH)=3v逆(H2)
b.CO2、H2、CH3OH和H2O浓度之比为1: 3 :1: 1
C.恒温恒压下,气体的体积不再变化
d.恒温恒容下,气体的密度不再变化
(3)在相同温度、相同容积的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器 | 容器1 | 容器2 | 容器3 |
反应物投入量 | 1mol CO2,3 mol H2 | 0.5mol CO2,1.5mol H2 | 1mol CH3OH,1mol H2O |
CH3OH的平衡浓度/mol·L-1 | c1 | c1 | c3 |
平衡时体系压强/Pa | p1 | p2 | p3 |
则下列各量的大小关系为c1_________(填“>”“<”或“=”,下同)c3,p2________p3。
(4)为提高燃料的能量利用率,常将其设计为燃料电池。某电池以甲烷为燃料,空气为氧化剂,熔融的K2CO3为电解质,以具有催化作用和导电性能的稀土金属为电极。写出该燃料电池的负极反应式:__________________________;为使电解质的组成保持稳定,使该燃料电池长时间稳定运行,在通入的空气中必须加入________________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了检验某溶液中是否含有常见的四种无机离子,某化学小组的同学进行了如下所示的实验操作。其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝。由该实验能得出的正确结论是( )

A.原溶液中一定含有SO42- B.原溶液中一定含有NH4+
C.原溶液中一定含有Cl- D.原溶液中一定含有Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe3+、SO42-、Mg2+、和X四种离子以物质的量之比2∶3∶2∶4大量共存于同一种溶液中,X可能是( )
A.NH4+B.OH-C.CO32-D.Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种短周期元素在周期表中的位置如图所示,Y原子的最外层电子数是次外层电子数的3倍,下列说法正确的是

A. X、Y、Z三种元素所形成的单质中,X的单质最稳定
B. Z元素的氧化物对应的水化物-定是一种强酸
C. Z单质在Y单质中燃烧可反应生成ZY3
D. Z单质与Fe反应生成的化合物中,铁元素显+3价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组为研究原电池原理,设计如图装置。
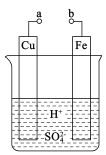
(1)a和b用导线连接,Fe电极的电极反应式为:________,Cu极发生_____反应,溶液中SO42-移向______(填“Cu”或“Fe”)极。
(2)无论a和b是否连接,Fe片均被腐蚀。若转移了0.4mol电子,则理论.上Fe片质量减轻____g。
(3)设计一个实验方案,使如图装置中的铁棒上析出铜,而铁不溶解(作图表示)。
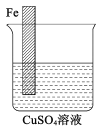 _____
_____
(4)依据Ba(OH)2·8H2O与NH4Cl晶体的反应原理设计原电池,你认为是否可行?理由是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验准备工作正确的是( )
A.将蒸发皿放置在铁架台的铁圈上,并垫石棉网加热
B.固体食盐盛装在细口试剂瓶内
C.结束氢气还原氧化铜的实验时,先熄灭酒精灯后撤出导管
D.将氢氧化钠溶液盛放在试剂瓶内,并用玻璃塞塞紧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制硫酸中的一步重要反应是S02在400~600℃下的催化氧化:2SO2+O2![]() 2SO3,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是 ( )
2SO3,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是 ( )
A. 使用催化剂是为了加快反应速率,提高生产效率
B. 达到平衡时,SO2的浓度与SO3的浓度相等
C. 为了提高SO2的转化率,应适当提高O2的浓度
D. 在上述条件下,SO2不可能100%的转化为SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 可用新制的Cu(OH)2悬浊液鉴别乙酸溶液、蔗糖溶液、葡萄糖溶液
B. 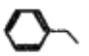 中所有碳原子一定处于同一平面
中所有碳原子一定处于同一平面
C. 苯乙烯、植物油和苯都能与氢气发生加成反应,是因为其结构中都含有碳碳双键
D. 有机物(C4H10)的一溴代物有六种结构
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com