
【题目】Fe3+、SO42-、Mg2+、和X四种离子以物质的量之比2∶3∶2∶4大量共存于同一种溶液中,X可能是( )
A.NH4+B.OH-C.CO32-D.Cl-
科目:高中化学 来源: 题型:
【题目】常温下,用0.10 molL-1 NaOH溶液滴定20.00mL 0.10molL-1的CH3COOH溶液,所得滴定曲线如图。下列说法正确的是
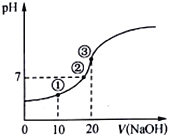
A. 点①所示溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B. 点②所示溶液中:c(Na+)=c(CH3COO-),酸碱恰好完全反应
C. 点③所示溶液中:c(OH-)-(H+)=c(CH3COOH)
D. 滴定过程中:c(CH3COO-)+c(CH3COOH)= 0.10molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质和应用对应关系正确的是
A. 晶体硅熔点高、硬度大,是制造太阳能电池和计算机芯片的主要材料
B. 氧化铝熔点高,常用于耐高温材料
C. 明矾溶于水能形成胶体,可用于自来水的杀菌消毒
D. 苏打溶液呈弱碱性,可用作胃酸中和剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一点条件下,RO3n-+F2+aOH-=RO4- +2F-+H2O,下列叙述正确的是( )
A.n=2,a=2B.n=2,a=1
C.RO3n-中R的化合价为+6D.n=1,a=2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在盛有碘水的试管中,加入少量四氯化碳后振荡,静置片刻后( )
A.整个溶液变紫色
B.整个溶液变棕色
C.上层几乎无色,下层紫红色
D.下层几乎无色,上层紫红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作正确的是( )
A.分液时,上下层液体均从下口放出
B.蒸馏时忘记放碎瓷片可停止加热,冷却后补加
C.蒸发结晶时,应将蒸发皿中的溶液全部蒸干
D.过滤时,为加快过滤速度可搅拌漏斗内的液体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子检验的方法正确的是
A. 某溶液![]() 生成无色气体,说明原溶液中有CO32-
生成无色气体,说明原溶液中有CO32-
B. 某溶液![]() 溶液变为血红色,说明原溶液中有Fe2+
溶液变为血红色,说明原溶液中有Fe2+
C. 某溶液![]() 有白色沉淀,说明原溶液中有SO42-
有白色沉淀,说明原溶液中有SO42-
D. 某溶液![]() 产生使湿润的红色石蕊试纸变蓝的气体,说明原溶液中有NH4+
产生使湿润的红色石蕊试纸变蓝的气体,说明原溶液中有NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在强酸性无色溶液中,可以大量共存的离子组是( )
A.Na+、K+、CO32-、Cl-B.Al3+、K+、SO42-、Cl-
C.K+、Cu2+、Cl-、NO3-D.K+、Ag+、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁被誉为“第一金属”,铁及其化合物在生活中有广泛应用。
(1)基态Fe2+的简化电子排布式为____________________。
(2)实验室可用KSCN、苯酚( )来检验Fe3+ 。N、O、S三种元素的第一电离能由大到小的顺序为 _______________(用元素符号表示),苯酚中碳原子的杂化轨道类型为_________。
)来检验Fe3+ 。N、O、S三种元素的第一电离能由大到小的顺序为 _______________(用元素符号表示),苯酚中碳原子的杂化轨道类型为_________。
(3)FeCl3的熔点为306 ℃,沸点为315 ℃。FeCl3的晶体类型是_____________ 。FeSO4常作净水剂和补铁剂,SO42- 的立体构型是___________________。
(4)羰基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等。1 mol Fe(CO)5分子中含______molσ键,与CO互为等电子体的离子是 _________________(填化学式,写一种)。
(5)氮化铁晶体的晶胞结构如图1所示。该晶体中铁、氮的微粒个数之比为________。
(6)氧化亚铁晶体的晶胞如图2所示。已知:氧化亚铁晶体的密度为ρg/cm3 ,NA代表阿伏加德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为 ________ ;Fe2+与O2-最短核间距为 __________ pm。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com