
【题目】某化学课外兴趣小组为探究NO气体易被空气氧化,并观察NO气体的实际颜色,同时为了防止气体扩散污染空气,对实验室制取NO气体的装置改装如下:
打开止水夹Ⅰ,Ⅱ,从漏斗处加入稀硝酸,直至液面浸没铜丝并与试管A胶塞处相平齐时,关闭止水夹Ⅰ,Ⅱ,用酒精灯微热试管A.
(1)加入稀硝酸与试管A胶塞处相平齐的目的是 .
(2)当用酒精灯微热试管A时,A中反应加快,请写出反应方程式 .
(3)当进入B试管的液体没及铜丝后,再微热B试管,此时B试管中能观察到的现象是 .
(4)为了防止气体污染空气,C烧杯中应装入溶液.
A.NaOH 溶液
B.CuSO4溶液
C.NaCl溶液
D.AgNO3溶液、
【答案】
(1)使A试管中的空气全部排空
(2)3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O
(3)B试管内溶液颜色加深,并有无色气体放出
(4)A
【解析】解:(1)加入稀硝酸与试管A胶塞处相平齐,可将A中的空气排除,以防止NO被氧化应影响实验的观察,
所以答案是:使A试管中的空气全部排空;
(2)A中稀硝酸与铜反应生成硝酸铜、NO和水,反应的化学方程式为3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O,
所以答案是:3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O;
(3)稀硝酸进入B中,B中稀硝酸反应生成NO,且溶液变为蓝色,
所以答案是:B试管内溶液颜色加深,并有无色气体放出;
(4)吸收氮氧化物,可用氢氧化钠溶液,以防止污染空气,
所以答案是:A.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】有机化合物甲有镇咳、镇静的功效,其合成路线如下:

已知: (R、R'、R"代表烃基或氢)
(R、R'、R"代表烃基或氢)
(1)有机物甲的分子式为___________,有机物A中含有的官能团的名称为_________________。
(2)有机物B的名称是____________,由B→D 所需的反应试剂和反应条件为_______________。
(3)在上述①~⑤反应中,属于取代反应的有____________(填序号)。
(4)写出E→F的化学方程式____________________________。
(5)写出同时满足下列条件的甲的同分异构体的结构简式________。
(Ⅰ)属于芳香族化合物 (Ⅱ)核磁共振氢谱上只有2组峰
(6)根据题给信息,写出以CH4为原料制备CH3CHO的合成路线(其他试剂任选)___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将20mL 0.5molL﹣1K2SO3溶液逐滴加入到20mL 0.2molL﹣1 硫酸酸化的紫色KMnO4溶液中,溶液恰好变为无色.则Mn元素在产物中的存在形态是( )
A.Mn
B.Mn2+
C.Mn2O3
D.K2MnO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用浓氨水检查氯气管道是否泄漏,发生反应为:8NH3 +3C12=N2+6NH4C1, 该反应属于
A. 置换反应 B. 分解反应 C. 化合反应 D. 复分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请完成下列问题
(1)已知红磷比白磷稳定,则反应
P4(白磷,s)+5O2(g)═2P2O5(s)△H1;
4P(红磷,s)+5O2(g)═2P2O5(s)△H2;
△H1和△H2的关系是△H1△H2(填“>”、“<”)
(2)由N2O和NO反应生成1mol N2和NO2的能量变化如图所示,请写出该反应的热化学方程式
(3)在298K、101kPa时,已知:
①2H2O(g)═O2(g)+2H2(g)△H1;
②Cl2(g)+H2(g)═2HCl(g)△H2;
③2Cl2(g)+2H2O(g)═4HCl(g)+O2(g)△H3 ,
则△H3与△H1和△H2之间的关系正确的是 .
A.△H3=△H1+2△H2
B.△H3=△H1+△H2
C.△H3=△H1﹣2△H2
D.△H3=△H1﹣△H2
(4)已知H2(g)+Br2(g)═2HBr(g)△H=﹣72kJmol﹣1 , 相关键能数据如表:
物质 | H2(g) | Br2(g) | HBr(g) |
1mol分子中的化学键断裂时需要吸收的能量(kJ) | 436 | 200 | a |
则表中a= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气是一种重要的化工原料,可用来生产氢气和甲醇等高附加值化学品。回答下列问题:
(1)以天然气为原料制取氢气是工业上常用的制氢方法。
已知:
①CH4(g)+H2O(g) =CO(g)+3H2(g) ΔH1=a kJ·mol-1
②CH4(g)+CO2(g) =2CO(g)+2H2(g) ΔH2=b kJ·mol-1
③CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH3
请计算上述反应中的反应热ΔH3=_________(用a、b表示)kJ·mol-1。
(2)合成甲醇的反应原理为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) 在1L的密闭容器中,充入1mol CO2和3 mol H2,在500℃下发生反应,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) 在1L的密闭容器中,充入1mol CO2和3 mol H2,在500℃下发生反应,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
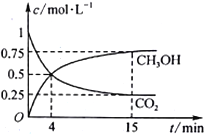
①反应进行到4 min 时,v(正)____ (填“>”“<”或“=”)v(逆)。0~4 min,CO2的平均反应速率v(CO2)=____________mol·L-1·min-1。
②CO2的平衡转化率为_______________,该温度下平衡常数为_____________。
③下列能说明该反应已达到平衡状态的是______________。
a.v正(CH3OH)=3v逆(H2)
b.CO2、H2、CH3OH和H2O浓度之比为1: 3 :1: 1
C.恒温恒压下,气体的体积不再变化
d.恒温恒容下,气体的密度不再变化
(3)在相同温度、相同容积的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器 | 容器1 | 容器2 | 容器3 |
反应物投入量 | 1mol CO2,3 mol H2 | 0.5mol CO2,1.5mol H2 | 1mol CH3OH,1mol H2O |
CH3OH的平衡浓度/mol·L-1 | c1 | c1 | c3 |
平衡时体系压强/Pa | p1 | p2 | p3 |
则下列各量的大小关系为c1_________(填“>”“<”或“=”,下同)c3,p2________p3。
(4)为提高燃料的能量利用率,常将其设计为燃料电池。某电池以甲烷为燃料,空气为氧化剂,熔融的K2CO3为电解质,以具有催化作用和导电性能的稀土金属为电极。写出该燃料电池的负极反应式:__________________________;为使电解质的组成保持稳定,使该燃料电池长时间稳定运行,在通入的空气中必须加入________________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温下,物质的量之比为2∶1的SO2和O2的混合气体在容积为2L的恒容密闭容器中发生反应:2SO2(g)+O2(g)![]() 2SO3(g)(正反应为放热反应),n(SO2)随时间变化关系如下表:
2SO3(g)(正反应为放热反应),n(SO2)随时间变化关系如下表:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
n(SO2)/mol | 0.20 | 0.16 | 0.13 | 0.11 | 0.08 | 0.08 |
下列说法正确的是( )
A. 该反应进行到第3分钟时,逆反应速率大于正反应速率
B. 若要提高SO2的转化率,可用空气代替纯氧气并鼓入过量空气
C. 从反应开始到达到平衡,用SO3表示的平均反应速率为0.01mol/(L·min)
D. 容器内达到平衡状态时的压强与起始时的压强之比为5∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实与胶体性质无关的是( )
A.在豆浆里加入盐卤做豆腐
B.在河流入海口易形成沙洲
C.一束平行光线照射蛋白质溶液时,从侧面可以看到一条光亮的通路
D.三氯化铁溶液中滴入氢氧化钠溶液出现红褐色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种短周期元素在周期表中的位置如图所示,Y原子的最外层电子数是次外层电子数的3倍,下列说法正确的是

A. X、Y、Z三种元素所形成的单质中,X的单质最稳定
B. Z元素的氧化物对应的水化物-定是一种强酸
C. Z单质在Y单质中燃烧可反应生成ZY3
D. Z单质与Fe反应生成的化合物中,铁元素显+3价
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com