
| A.除去Fe粉中混有的I2:加热使I2升华 |
| B.除去NaCl固体中混有的MgCl2:加入KOH溶液后过滤,滤液蒸发结晶 |
| C.除去碳酸钠中混有的碳酸氢钠:加入过量的氢氧化钠溶液,蒸发结晶 |
| D.除去氢氧化镁中混有的氢氧化钙:加入水中搅拌成浆状后,加入足量氯化镁溶液,加适量水过滤洗涤 |
 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案 培优三好生系列答案
培优三好生系列答案科目:高中化学 来源:不详 题型:单选题
| A.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
| B.加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ |
| C.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- |
| D.加入碳酸钠溶液产生白色沉淀,再加盐酸,白色沉淀消失,一定有Ba2+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
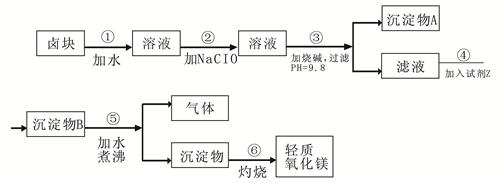
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
| 试剂 | 价格(元/吨) |
| 漂液(含NaClO,25.2%) | 450 |
| 双氧水(含H2O2 ,30%) | 2400 |
| 烧碱(含98% NaOH) | 2100 |
| 纯碱(含99.5% Na2CO3) | 600 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
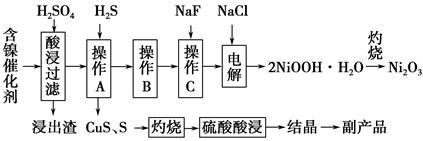
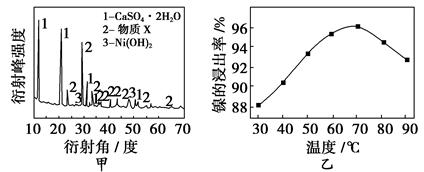
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 向溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液 | 出现白色沉淀 | 溶液X中一定含有SO42- |
| B | 用铂丝蘸取溶液Y进行焰色反应 | 火焰呈黄色 | 溶液Y中含Na+,不含K+ |
| C | 向一定浓度的Na2SiO3溶液中通入适量CO2气体 | 出现白色沉淀 | H2SiO3的酸性比H2CO3的酸性强 |
| D | 向饱和Na2CO3溶液中通入足量CO2 | 溶液变浑浊 | 析出了NaHCO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
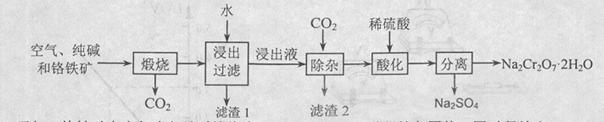
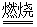 2NaAlO2+CO2↑。请回答:
2NaAlO2+CO2↑。请回答: ,再加入可溶性硫酸盐处理多余的Ba2+。加入可溶性钡盐后的废水中Ba2+的浓度应不小于 mol/L,后续废水处理方能达到国家排放标准。
,再加入可溶性硫酸盐处理多余的Ba2+。加入可溶性钡盐后的废水中Ba2+的浓度应不小于 mol/L,后续废水处理方能达到国家排放标准。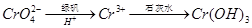 。写出酸性条件下 CrO42-与绿矾在溶液中反应的离子方程式 。
。写出酸性条件下 CrO42-与绿矾在溶液中反应的离子方程式 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 实验目的 | 操作 |
| A | 确定碳和硅两元素非金属性强弱 | 测同温同浓度Na2CO3和Na2SiO3水溶液的pH |
| B | 除去苯中混有的苯酚 | 向混合液中加入浓溴水,充分反应后,过滤 |
| C | 证明SO2具有漂白性 | 将SO2通入酸性KMnO4溶液中 |
| D | 证明氯乙烷中含氯元素 | 向氯乙烷中滴几滴AgNO3溶液再滴加稀HNO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com