
【题目】元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。
(1)与氯元素同族的短周期元素的原子结构示意图为___________________。
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是_________(填序号)。
a.Cl2、Br2、I2的熔点 b. Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性 d.HCl、HBr、HI的酸性
(3)工业上,通过如下转化可制得KClO3晶体:
NaCl溶液![]() NaClO3溶液
NaClO3溶液![]() KClO3晶体
KClO3晶体
①完成I中反应的总化学方程式: ___NaCl+___H2O 电解 NaClO3+_________。
②II中转化的基本反应类型是____________________,该反应过程能析出KClO3晶体而无其它晶体析出的原因是_______________________________。
(4)一定条件,在水溶液中1 mol Cl-、![]() (x=1,2,3,4)的能量(kJ)相对大小如图所示。
(x=1,2,3,4)的能量(kJ)相对大小如图所示。

①D是__________________(填离子符号)。
②B→A+C反应的离子方程式为______________________。
【答案】![]() b c 1 3 3H2 复分解反应 室温下,氯酸钾在水中的溶解度明显小于其它晶体 ClO4- 3ClO- = ClO3- + 2Cl-
b c 1 3 3H2 复分解反应 室温下,氯酸钾在水中的溶解度明显小于其它晶体 ClO4- 3ClO- = ClO3- + 2Cl-
【解析】
(1)与氯元素同族的短周期元素只有F原子,它的结构示意图为![]() ,
,
故答案为:![]() ;
;
(2)卤族元素最外层电子数相等,但随着原子序数增大,原子半径增大,原子核对最外层电子吸引力减小,其非金属性减弱,元素的非金属性越强,其氢化物的稳定性越强、其最高价氧化物的水化物酸性越强、其单质的氧化性越强,与物质的沸点、氢化物水溶液的酸性无关,故选bc,
故答案为:bc;
(3)①根据氧化还原反应得失电子数相等可推断出,I中反应的总化学方程式为NaCl+3H2O 电解 NaClO3+3H2↑,
故答案为:1,3,3H2;
②NaClO3转化为KClO3,说明该反应中两种物质相互交换离子生成盐,为复分解反应,相同温度下,溶解度小的物质先析出,室温下KClO3在水中的溶解度肯定小于其它晶体,所以先析出KClO3,
故答案为:复分解反应;室温下KClO3在水中的溶解度明显小于其它晶体;
(4)①根据图象知,D中Cl元素化合价为+7价,所以ClOx-中x为4,则D为ClO4-,故答案为:ClO4-;
②B→A+C,根据转移电子守恒得该反应方程式为3ClO-=ClO3-+2Cl-,
故答案为:3ClO-=ClO3-+2Cl-。


科目:高中化学 来源: 题型:
【题目】铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
(1)Cu位于元素周期表第ⅠB族。Cu2+的电子排布式为____________________。
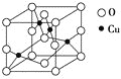
(2)下图是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为________。
(3)胆矾CuSO4·5H2O可写成[Cu(H2O)4]SO4·H2O,其结构示意图如下:
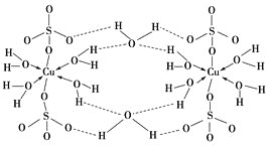
下列说法正确的是________(填字母)。
A.在上述结构示意图中,所有氧原子都采用sp3杂化
B.在上述结构示意图中,存在配位键、共价键和离子键
C.胆矾是分子晶体,分子间存在氢键
D.胆矾中的水在不同温度下会分步失去
(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥型,但NF3不易与Cu2+形成配离子,其原因是_________________________。
(5)Cu2O的熔点比Cu2S的________(填“高”或“低”),请解释原因________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分类中,所属关系不符合“X包含Y、Y包含Z”的有
选项 | X | Y | Z |
A | 芳香族化合物 | 芳香烃的衍生物 |
|
B | 脂肪族化合物 | 链状烃的衍生物 | CH3COOH(乙酸) |
C | 环状化合物 | 芳香族化合物 | 苯的同系物 |
D | 不饱和烃 | 芳香烃 |
|
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构如图所示,有关该有机物的说法不正确的是

A. 该有机物的分子式为 C20H14O4
B. 该有机物分子中所有的原子不可能处于同一平面
C. 1mol 该有机物分别与 Br2、NaOH 反应, 最多能消耗 4molBr2、4molNaOH
D. 该有机物能发生加成、取代、氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向 100mL Na2CO3 与 NaAlO2 的混合溶液中逐滴加入 1mol/L 的盐酸,测得溶液中的 CO32-、HCO3- 、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示。下列说法正确的是

A. 原 混 合 溶 液 中 的 n (CO32-): n (AlO2-)=2:1
B. a 点溶液中:c(HCO3-)+c(H2CO3)+c(H+)=c(OH-)
C. b 点溶液中离子浓度顺序为:c(Cl-)>c(HCO3-)>c(CO32-)>c(OH- )
D. d→e 的过程中水的电离程度逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中字母分别代表一种元素。回答下列问题。
周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | a | b | c | d | ||||
3 | e | f | g | x | y | z |
(1)表中所标元素,最活泼的金属元素形成简单离子符号为____;最不活泼的元素的原子结构示意图为 _____;其中一种元素的气态氢化物与其最高价氧化物的水化物可直接化合生成一种盐,该盐是_______。
(2)写出两种满足下列条件的物质______(写化学式)。
①由c、x、e组成的;②含有共价键的离子化合物。
(3)g、x、y的气态氢化物,最稳定的是______(填化学式)。
(4)表中元素的最高价氧化物的水化物中:酸性最强的是______(填化学式,下同);碱性最强的是_______,这两种物质反应的离子方程式为_________。
(5)推测元素的非金属性:a ______ g(填“>”或“<”)。利用图装置设计实验,证明推测结论。
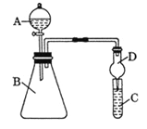
①仪器A的名称为___________,干燥管D的作用是______________。
②填空。
装置内试剂 | C中发生反应的化学方程式 | ||
A | B | C | |
稀硫酸 | 碳酸钠 | _______ | _______ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚乳酸(PLA),是一种无毒性、可再生、可分解的高分子聚合物塑料,PLA早期是开发在医学上使用,作手术缝合线及骨钉等,现在则已较广泛的应用于一些常见的物品,如:包装袋、纺织纤维,PLA由植物中萃取出淀粉(玉米、甜菜、小麦、甘薯等)或用纤维素(玉米干草、麦杆、甘蔗渣等木质的农业废弃物)经过下列过程制造而成:
淀粉或纤维素![]() 葡萄糖
葡萄糖![]() 乳酸
乳酸![]() 聚乳酸
聚乳酸
根据上述信息,回答下列问题:
(1)淀粉水解生成葡萄糖的化学方程式为_________;
(2)已知1mol葡萄糖![]() 2mol乳酸,转化过程中无其它反应物、生成物,则乳酸的分子式为_________;
2mol乳酸,转化过程中无其它反应物、生成物,则乳酸的分子式为_________;
(3)某研究性小组为了研究乳酸(无色液体,与水混溶)的性质,做了如下实验:
①取1.8g乳酸与过量的饱和NaHCO3溶液反应,测得生成的气体体积为448mL(气体体积已换算为标准状况下体积);
②另取1.8g乳酸与过量的金属钠反应,测得生成的气体体积为448mL(气体体积已换算为标准状况下体积)。
由实验数据推知乳酸分子含有_________(填官能团名称),从以上条件推知乳酸的结构简式可能为_________;
(4)经现代化学仪器分析,测定乳酸分子中含有一个甲基.请写出乳酸分子之间通过酯化反应生成的六元环状化合物的结构简式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某分子的球棍模型如图所示。已知分子中所有原子的最外层均达到8电子稳定结构,原子间以单键相连。下列有关说法中错误的是( )

A. X原子可能为第ⅤA族元素
B. Y原子一定为第ⅠA族元素
C. 该分子中既含有极性共价键又含有非极性共价键
D. 从圆球的大小分析,该分子可能为N2F4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com