
【题目】由玉米芯制取的糠醛是一种广泛使用的化工原料。玉米芯的主要成分多缩戊糖是一种糖,在硫酸或盐酸等催化剂的作用下能转化为戊糖,戊糖再在高温下经脱水环化生成糠醛(![]() )。通常条件下,糠醛是无色油状液体,在空气中易变成黄棕色,能溶于丙酮、苯、乙醚等有机溶剂中,能与水部分互溶。糠醛用途广泛,如:用糠醛替代甲醛与苯酚在酸或碱催化下合成酚醛树脂,可用作砂轮、砂纸、砂布的粘合剂;糠醛的氧化产物己二酸是合成锦纶纤维的重要单体;糠醛在以CuO-Cr2O3作为催化剂并加热加压的条件下,可制得糠醇(
)。通常条件下,糠醛是无色油状液体,在空气中易变成黄棕色,能溶于丙酮、苯、乙醚等有机溶剂中,能与水部分互溶。糠醛用途广泛,如:用糠醛替代甲醛与苯酚在酸或碱催化下合成酚醛树脂,可用作砂轮、砂纸、砂布的粘合剂;糠醛的氧化产物己二酸是合成锦纶纤维的重要单体;糠醛在以CuO-Cr2O3作为催化剂并加热加压的条件下,可制得糠醇(![]() ),糠醇可以合成多种树脂;此外,糠醛还是合成香料、药物、染料等的原料。
),糠醇可以合成多种树脂;此外,糠醛还是合成香料、药物、染料等的原料。
根据以上材料,结合所学知识,回答以下问题:
(1)糠醛的分子式是______________,其核磁共振氢谱显示_______组峰。
(2)下列说法正确的是_______________(填序号)
a. 糠醛在空气中易被氧化而变色 b. 可以用分液法分离糠醛和丙酮的混合物
c. 可以用糠醛萃取溴水中的溴 d. 1mol糠醛最多可与3 mol H2加成
(3)糠醛树脂的合成原理与甲醛和苯酚反应类似,写出在酸性条件下糠醛与苯酚反应的化学方程式________________________________________________________。
(4)糠醛制取糠醇的化学方程式___________________________________________。
(5)糠醛的氧化产物己二酸与另一单体在一定条件下合成锦纶纤维![]() 其反应的化学方程式是_________________________________________。
其反应的化学方程式是_________________________________________。
【答案】C5H4O2 4 ad  H2 +
H2 +![]()
![]() +(2n-1)H2O
+(2n-1)H2O
【解析】
(1)由 ![]() 判断含有的C、H、O数目,可以知道分子式;结构不对称,含4种H;
判断含有的C、H、O数目,可以知道分子式;结构不对称,含4种H;
(2)a.糠醛是无色油状液体,在空气中易变成黄棕色;
b.糠醛和丙酮互溶;
c.糠醛含碳碳双键,与溴水发生加成反应;
d. ![]() 中2个双键与醛基均与氢气发生加成反应;
中2个双键与醛基均与氢气发生加成反应;
(3)类比甲醛和苯酚反应原理分析;
(4)糠醛制取糠醇,醛基转化为羟基;
(5)合成锦纶纤维 ![]() ,由己二酸与己二胺发生缩聚反应生成;
,由己二酸与己二胺发生缩聚反应生成;
(1)由 ![]() 可以知道含有的C原子数为5、H原子数为4、O原子数为2,分子式为C5H4O2;结构不对称,含4种H,其核磁共振氢谱显示4组峰, 故正确答案是: C5H4O2;4;
可以知道含有的C原子数为5、H原子数为4、O原子数为2,分子式为C5H4O2;结构不对称,含4种H,其核磁共振氢谱显示4组峰, 故正确答案是: C5H4O2;4;
(2)a.糠醛是无色油状液体,在空气中易变成黄棕色,在空气中易被氧化而变色,故a项正确;
b.糠醛和丙酮互溶,不能分液分离,故b项错误;
c.糠醛含碳碳双键,与溴水发生加成反应,则不能作萃取剂,故c项错误;
d. ![]() 中2个双键与醛基均与氢气发生加成反应,则1mol糠醛最多可与3mol 氢气加成,故d项正确;
中2个双键与醛基均与氢气发生加成反应,则1mol糠醛最多可与3mol 氢气加成,故d项正确;
故正确答案是:ad;
(3)在酸性条件下糠醛与苯酚发生缩聚反应,方程式为: ,故正确答案为:
,故正确答案为: ;
;
(4)糠醛制取糠醇,醛基转化为羟基,化学反应为 : H2 +![]()
故正确答案是: H2 +![]() ;
;
(5)合成锦纶纤维 ![]() ,由己二酸与己二胺发生缩聚反应生成,反应为
,由己二酸与己二胺发生缩聚反应生成,反应为 ![]() +(2n-1)H2O。
+(2n-1)H2O。


科目:高中化学 来源: 题型:
【题目】聚四氟乙烯的耐热性和化学稳定性超过其他塑料,被称为“塑料王”。其合成路线如下:
三氯甲烷![]() 二氟一氯甲烷
二氟一氯甲烷![]() 四氟乙烯
四氟乙烯![]() 聚四氟乙烯
聚四氟乙烯
下列说法中不正确的是( )
A.“塑料王”不能使酸性高锰酸钾溶液褪色
B.三氯甲烷(CHCl3)可以用甲烷与氯气的取代反应制得
C.四氟乙烯(CF2=CF2)中所有的原子都在同一平面上
D.二氟一氯甲烷(CHClF2)中所有原子最外层电子都达到了8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅氧化还原液流电池作为一种新型铅电池,具有一定的应用前景,正在逐渐成为电化学储能领域的一个研究热点。该电池以酸性甲基磺酸铅溶液为电解液,简化的工作原理如图所示,下列说法正确的是( )
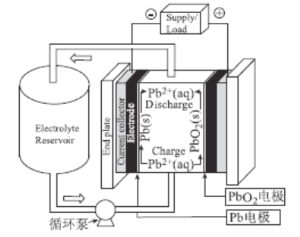
A.放电时,H+经过循环泵向Pb电极移动
B.放电时,正极反应式为PbO2+4H++2e-=Pb2++2H2O
C.充电时,阴极反应式为2H++2e-=H2↑
D.该电解液可用稀H2SO4替代,放电效果相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KMnO4在实验室、生活、科学研究、工业生产中有广泛的应用。已知一种制备KMnO4的实验流程、原理及相关数据如下:

原理:反应I:3MnO2+KClO3+6KOH![]() 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O
反应Ⅱ:3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
(墨绿色) (紫红色)
已知:25℃物质的溶解度g/100g水
K2CO3 | KHCO3 | KMnO4 |
111 | 33.7 | 6.34 |
(1)步骤②的副反应有少量单质气体生成,该反应的化学方程式为___________。
(2)步骤⑤中CO2______(填“能”或“不”能)过量,原因是_____________。
(3)流程中可循环利用的物质主要是_________(写化学式)。
(4)忽略本流程中含锰物质的循环利用,理论上0.3mol MnO2最多得到产品KMnO4的质量为________g。某同学在实验中得到干燥产品的质量多于理论值,排除称量因素,从步骤⑦分析,可能的原因是_______________。
(5)草酸钠滴定法分析高锰酸钾纯度步骤如下:
Ⅰ.称取1.5800g高锰酸钾产品,配成100mL溶液
Ⅱ.准确称取三份0.5360g已烘干的Na2C2O4,置于三个不同的洁净锥形瓶中,分别加入少量蒸馏水使其溶解,再加入少量硫酸酸化;
Ⅲ.锥形瓶中溶液加热到75~80℃,趁热用I中配制的高锰酸钾溶液滴定至终点。记录实验数据如表
实验次数 | V1(滴定前读数/mL) | V2(滴定后读数/mL) | (V2 -V1)/mL |
1 | 2.65 | 22.67 | 20.02 |
2 | 2.60 | 23.02 | 20.42 |
3 | 2.60 | 22.58 | 19.98 |
已知:2MnO4﹣+ 5C2O42﹣+16H+ =2Mn2++ 10CO/span>2↑+ 8H2O,则KMnO4的纯度为__________(保留四位有效数字);若滴定后俯视滴定管读数,所得KMnO4的纯度将___(填“偏高”或“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有对氯苯酚和醋酸钠的废水净化原理如图所示。下列说法错误的是( )
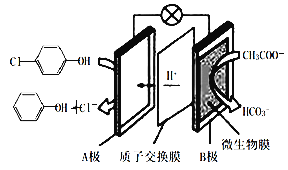
A.本装置集净化、供电于一体,产物之一还有消毒作用
B.每消耗1mol CH3COO-,通过质子交换膜的质子的物质的量为8mol
C.在该装置中,B极上的电势比A极上的电势高
D.A极的电极反应为![]() +H++2e-→
+H++2e-→![]() +Cl-
+Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚铁氰化钾(K4[Fe(CN)6])双称黄血盐,是一种重要的化工原料。检验三价铁发生的反应为:K4[Fe(CN)6]+FeCl3=KFe[Fe(CN)6]↓(滕氏蓝) +3KCl,回答问题:
(1)写出基态Fe3+的核外电子排布式_________。
(2)K4[Fe(CN)6]中的作用力除共价键外,还有______和________。含有12mol σ键的K4[Fe(CN)6的物质的量为________mol。
(3)黄血盐中N原子的杂化方式为______;C、N、O的第一电离能由大到小的排序为_____,电负性由大到小的排序为________。
(4)Fe、Na、K的晶体结构如图所示:

① 钠的熔点比钾更高,原因是__________________________。
② Fe原子半径是r cm,阿伏加德罗常数为NA,铁的相对原子质量为a,则铁单质的密度是_______g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图像分别表示有关反应的反应过程与能量变化的关系。
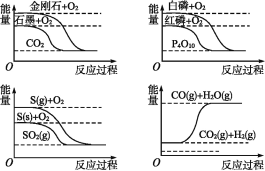
据此判断下列说法中正确的是( )
A.石墨转变为金刚石是吸热反应
B.S(g)+O2(g)![]() SO2(g) ΔH1,S(s)+O2(g)
SO2(g) ΔH1,S(s)+O2(g)![]() SO2(g) ΔH2,则ΔH1>ΔH2
SO2(g) ΔH2,则ΔH1>ΔH2
C.白磷比红磷稳定
D.CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH>0
CO2(g)+H2(g) ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、恒容密闭容器中发生反应: A(s) +2B(g)![]() C(g)+D(g),当下列物理量不再发生变化时,表明该反应已达到平衡状态的是
C(g)+D(g),当下列物理量不再发生变化时,表明该反应已达到平衡状态的是
①混合气体的压强 ②混合气体的密度 ③各气态物质的物质的量浓度
④气体的总物质的量 ⑤混合气体的平均相对分子质量
A. ②③⑤ B. ①②③ C. ②③④⑤ D. ①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是 ( )
A.明矾溶液中加入过量的氨水 Al3++4OH-=AlO2-+2H2O
B.次氯酸钙溶液中通入过量二氧化碳:ClO-+H2O+CO2=HClO+CO32-
C.用石墨作电极电解饱和食盐水: ![]()
D.澄清的石灰水中加入少量的NaHCO3溶液:Ca2++2OH-+2HCO3-=CaCO3↓+ 2H2O + CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com