
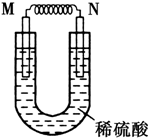
 由铜片、铁片和200mL稀H2SO4组成的原电池中,若铁片只发生电化学反应,则当N极上共放出5.6L (标准状况)气体时,H2SO4恰好完全消耗.
由铜片、铁片和200mL稀H2SO4组成的原电池中,若铁片只发生电化学反应,则当N极上共放出5.6L (标准状况)气体时,H2SO4恰好完全消耗.分析 (1)铁与铜构成的原电池,活泼金属铁作负极,正极是氢离子放电生成氢气,电子由负极流向正极,而N极上共放出气体,所以N是正极;
(2)生成氢气的物质的量为:$\frac{5.6L}{22.4L/mol}$=0.25mol,生成1mol的电子转移电子数为2mol,由此分析解答;
(3)根据反应总方程式为:H2SO4~H2,由此分析解答.
解答 解:(1)铁与铜构成的原电池,活泼金属铁作负极,正极是氢离子放电生成氢气,电子由负极流向正极,而N极上共放出气体,所以N是正极,则M电极材料为负极,M为电极材料为铁,电极反应式为:Fe-2e-=Fe2+,原电池的电子是由铁流向铜,故答案为:Fe;Fe-2e-=Fe2+; Fe;Cu;
(2)生成氢气的物质的量为:$\frac{5.6L}{22.4L/mol}$=0.25mol,生成1mol的电子转移电子数为2mol,所以转移电子0.25mol×2=0.5mol,答:当反应结束时,导线上转移电子的物质的量0.5mol;
(3)根据反应总方程式为:H2SO4~H2,所以n(H2SO4)=n(H2)=$\frac{0.25mol}{0.2L}$=1.25mol/L,答:稀H2SO4溶液的物质的量浓度是1.25mol/L.
点评 本题以原电池原理为载体,考查方程式的有关计算,题目难度不大,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:选择题
| A. | $\frac{KW}{c(H+)}$=1×10-13 mol•L-1的溶液中:Fe2+、K+、NO3-、SO42- | |
| B. | 使酚酞试液变红色的溶液中:Na+、Ba2+、NO3-、Cl- | |
| C. | c(Fe3+)=0.1 mol•L-1的溶液中:Na+、Cl-、SCN-、SO42- | |
| D. | 水电离的c(H+)=1×10-13 mol•L-1的溶液中:K+、Na+、Br-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NA个氮气分子与NA个一氧化碳分子所含的电子数相等 | |
| B. | 在标准状况下,1摩尔铜恰好与400ml 10mol/L的浓硝酸反应,可收集到22.4L的气体 | |
| C. | 2mol•L-1 氨水溶液中含有2NA个NH4+ | |
| D. | 1mol氨气溶于1升水中,所得溶液的浓度为1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 石油主要含有碳、氢两种元素 | B. | 石油属于可再生矿物能源 | ||
| C. | 石油的裂化是化学变化 | D. | 石油分馏的各馏分均是纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
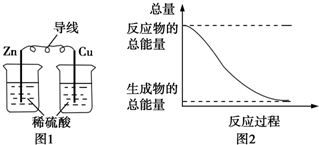
| A. | 图1所示的装置能将化学能转变为电能 | |
| B. | 图2所示的反应为吸热反应 | |
| C. | 中和反应中,反应物的总能量比生成物的总能量低 | |
| D. | 化学反应中能量变化的主要原因是化学键的断裂与生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该现象说明了NaHCO3难溶于水 | |
| B. | 滤液中的c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| C. | 滤液中c(Na+)+c(H+)+c(NH4+)=c(OH-)+c(HCO3-)+c(CO32-) | |
| D. | 滤液中c(Cl-)>c(NH4+)>c(HCO3-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 60 g ZY2中含有2 mol Z-Y极性共价键 | |
| B. | Y的氢化物比R的氢化物稳定,熔沸点高 | |
| C. | Z、W、R最高价氧化物对应水化物的酸性强弱顺序是:R>W>Z | |
| D. | X与Y形成的两种常见化合物中阴、阳离子的个数比均为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用萃取法分离汽油和水的混合液 | |
| B. | 用结晶法提纯NaC1和KNO3混合物中的KN03 | |
| C. | 直接蒸馏酒精溶液得到无水乙醇 | |
| D. | 除去FeC13溶液中少量的FeC12,加入足量的铁屑,充分反应后,过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 测定中和热时,大小两烧杯间填满碎纸的作用只是固定小烧杯 | |
| B. | 用50mL 0.50mo1•L-1的氢氧化钠溶液,分别与50mL 0.50mo1•L-1的盐酸和50mL 0.25mo1•L-1的硫酸充分反应,两反应测定的中和热相等 | |
| C. | 不能用铜丝代替玻璃棒搅拌酸碱混合液 | |
| D. | 酸碱混合时,量筒中NaOH溶液应缓缓倒入小烧杯中,不断用玻璃棒搅拌 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com