按要求回答下列问题
(1)某温度下,纯水中c (H+)=2.0×10-7mol?L-1,则此时c (OH-)=______mol?L-1;0.9mol?L-1NaOH溶液与0.1mol?L-1HCl溶液等体积混合(不考虑溶液体积变化)后,溶液的pH=______.
(2)向0.020mol?L-1的HCN溶液中加入0.020mol NaCN固体,溶液pH增大,主要原因是______;已知该混合溶液中c (Na+)>c (CN-),则c (HCN)______c (CN-)(用“>”、“<”、“=”符号填空).
(3)向1L 0.10mol?L-1的HCN溶液中加入0.08molNaOH固体,得到混合溶液,则______和______两种粒子的物质的量之和等于0.1mol;写出该混合溶液中存在的所有平衡的表达式______.
【答案】
分析:(1)纯水电离生成的c(H
+)=c(OH
-),Kw=c(H
+)×c(OH
-),过量的c(OH
-)=
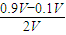
=0.4mol/L,结合Kw计算c(H
+),得出pH;
(2)存在HCN?H
++CN
-电离平衡,氢离子浓度减小则pH增大;该混合溶液中c (Na
+)>c (CN
-),则水解大于电离;
(3)向1L 0.10mol?L
-1的HCN溶液中加入0.08molNaOH固体,反应后生成0.08molNaCN,还剩余0.02molHCN,由物料守恒及电离平衡、水解平衡来解答.
解答:解:(1)纯水电离生成的c(H
+)=c(OH
-)=2.0×10
-7mol?L
-1,Kw=c(H
+)×c(OH
-)=4.0×10
-14mol?L
-1,过量的c(OH
-)=

=0.4mol/L,由该温度下的Kw可知,c(H
+)=
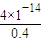
=10
-13mol?L
-1,所以pH=13,
故答案为:2.0×10
-7;13;
(2)存在HCN?H
++CN
-电离平衡,加入0.020mol NaCN固体,CN
-浓度增大,抑制了HCN的电离,使c(H
+)降低,pH值增大;该混合溶液中c (Na
+)>c (CN
-),则水解大于电离,所以c(HCN)>c (CN
-),
故答案为:CN
-浓度增大,抑制了HCN的电离,使c(H
+)降低,pH值增大;>;
(3)向1L 0.10mol?L
-1的HCN溶液中加入0.08molNaOH固体,反应后生成0.08molNaCN,还剩余0.02molHCN,由物料守恒可知,HCN、CN
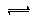
-两种粒子的物质的量之和等于0.1mol,溶液中存在电离平衡HCN
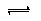
H
++CN
-、H
2O
H
++OH
-;水解平衡为CN
-+H
2O
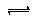
HCN+OH
-,
故答案为:HCN;CN
-;HCN
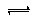
H
++CN
-、H
2O

H
++OH
-、CN
-+H
2O
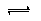
HCN+OH
-.
点评:本题考查酸碱混合溶液的定性判断及有关计算,明确水的电离、弱电解质的电离、盐类水解等知识即可解答,注意混合后溶液中的溶质判断为解答的关键,题目难度中等.

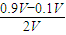 =0.4mol/L,结合Kw计算c(H+),得出pH;
=0.4mol/L,结合Kw计算c(H+),得出pH; =0.4mol/L,由该温度下的Kw可知,c(H+)=
=0.4mol/L,由该温度下的Kw可知,c(H+)=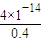 =10-13mol?L-1,所以pH=13,
=10-13mol?L-1,所以pH=13,

 名校课堂系列答案
名校课堂系列答案 A、B、C、D都是由短周期元素组成的常见物质,其中A、B、C均含同一种元素,在一定条件下相互转化关系如图所示(部分产物已略去).
A、B、C、D都是由短周期元素组成的常见物质,其中A、B、C均含同一种元素,在一定条件下相互转化关系如图所示(部分产物已略去). H++CN-、H2O
H++CN-、H2O H++OH-、CN-+H2O
H++OH-、CN-+H2O HCN+OH-
HCN+OH- H++CN-、H2O
H++CN-、H2O H++OH-、CN-+H2O
H++OH-、CN-+H2O HCN+OH-
HCN+OH-