
| A. | 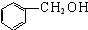 酚类-OH 酚类-OH | B. | 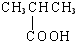 羧酸-CHO 羧酸-CHO | ||
| C. |  醛类-CHO 醛类-CHO | D. | CH3-O-CH3 醚类 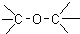 |
分析 决定有机物化学性质的原子或者原子团称为官能团,常见的官能团有:碳碳双键、碳碳三键、羟基-OH、醛基-CHO、羧基-COOH、醚基-O-、酯基-COO-等,以此解答该题.
解答 解:A.羟基连在苯环上的有机物称为酚,该有机物属于醇类,故A错误;
B.羧酸的官能团为羧基:-COOH,而-CHO为醛类的官能团醛基,故B错误;
C.该物质属于酯类,含有的官能团为酯基,故C错误;
D.醚类的官能团为醚基,醚基的结构简式为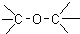 ,该物质为二甲醚,故D正确.
,该物质为二甲醚,故D正确.
故选D.
点评 本题考查了烃的衍生物的官能团的书写判断,题目难度不大,注意掌握常见的有机物官能团结构、类型,明确烃的衍生物类型与官能团之间的正确关系.


科目:高中化学 来源: 题型:解答题
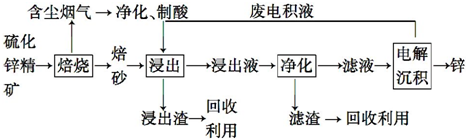
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K2SO4 HCl BaCl2 | B. | Na2CO3 K2SO4 KCl | ||
| C. | FeCl3 NaCl KOH | D. | CuSO4 HCl NaNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 将BaSO4放入水中不能导电,所以硫酸钡不是电解质 | |
| B. | NaCl溶液能导电,所以NaCl溶液是电解质 | |
| C. | 氯化氢溶于水能导电,但液态氯化氢不能导电 | |
| D. | 固态的NaCl不导电,熔融态NaCl可以导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
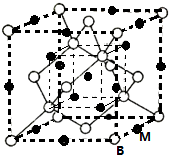 已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大.其中基态A原子价电子排布式为nsnnpn;化合物B2E为离子化合物,E原子核外的M层中只有两对成对电子;C元素基态原子没有不成对电子;D单质常用于制作太阳能电池和集成电路芯片;F原子最外层只有1个电子,其余各内层轨道均充满电子.请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大.其中基态A原子价电子排布式为nsnnpn;化合物B2E为离子化合物,E原子核外的M层中只有两对成对电子;C元素基态原子没有不成对电子;D单质常用于制作太阳能电池和集成电路芯片;F原子最外层只有1个电子,其余各内层轨道均充满电子.请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):查看答案和解析>>
科目:高中化学 来源: 题型:实验题
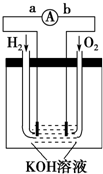 氢氧燃料电池是符合绿色化学理念的新型发电装置.
氢氧燃料电池是符合绿色化学理念的新型发电装置.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com