

| T/℃ | 20 | 40 | 60 | 80 |
| S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
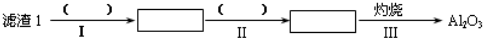
分析 锂辉石(Li2O•Al2O3•4SiO2,含少量Ca,Mg元素)经过研磨、加热、酸化得到可溶性的硫酸锂、硫酸铝和不溶的二氧化硅,经过过滤,得到滤渣1二氧化硅,滤液1经过调节PH值,使溶液得到滤液Mg(OH)2和CaCO3.向滤液1中加入石灰乳以增加Ca2+、OH-的浓度,使Mg(OH)2、CaCO3更利于析出,以便形成滤渣2,热水洗涤Li2CO3的溶解度随温度升高而减小,可减少Li2CO3的损失,得到最终产物碳酸锂,
(1)步骤Ⅱ中铝离子与氨水反应生成氢氧化铝沉淀;
(2)依据图表分析可知碳酸锂溶解度随温度升高减小;
(3)电解后向LiOH溶液中加入过量NH4HCO3溶液,氢氧化锂与碳酸氢铵反应生成碳酸锂.
解答 解:锂辉石(Li2O•Al2O3•4SiO2,含少量Ca,Mg元素)经过研磨、加热、酸化得到可溶性的硫酸锂、硫酸铝和不溶的二氧化硅,经过过滤,得到滤渣1二氧化硅,滤液1经过调节PH值,使溶液得到滤液Mg(OH)2和CaCO3.向滤液1中加入石灰乳以增加Ca2+、OH-的浓度,使Mg(OH)2、CaCO3更利于析出,以便形成滤渣2,热水洗涤Li2CO3的溶解度随温度升高而减小,可减少Li2CO3的损失,得到最终产物碳酸锂,
(1)步骤Ⅱ中反应是铝离子生成氢氧化铝的反应,反应离子方程式为:
Al3++3NH3•H2O=Al(OH)3↓+3NH4+,
故答案为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
(2)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”,图表中碳酸锂溶解度随温度升高减小,减少沉淀的损失,
故答案为:Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失;
(3)电解后向LiOH溶液中加入过量NH4HCO3溶液,氢氧化锂与碳酸氢铵反应生成碳酸锂的方程式为:2LiOH+NH4HCO3=Li2CO3↓+NH3+2H2O,
故答案为:2LiOH+NH4HCO3=Li2CO3↓+NH3+2H2O.
点评 本题考查了物质生产流程的分析判断,流程分析,为高频考点,侧重于学生分析能力,有利于培养学生良好的科学素养,注意把握物质性质的应用,题目侧重铝及其化合物性质的应用,氧化铝的提取方法,题目难度中等.


科目:高中化学 来源: 题型:解答题
 为测定含有Na2O杂质的Na2O2样品的纯度,甲同学设计以下的方案.用如图所示装置,通过测定Na2O2与C02反应生成02的体积来测定样品的纯度.
为测定含有Na2O杂质的Na2O2样品的纯度,甲同学设计以下的方案.用如图所示装置,通过测定Na2O2与C02反应生成02的体积来测定样品的纯度.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
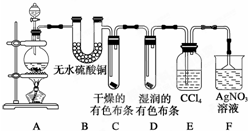 某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时探究氯气的漂白原理,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题.
某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时探究氯气的漂白原理,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液 | B. | 氨水 | C. | KMnO4,ZnCO3 | D. | H2O2,ZnO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子核都是由质子和中子构成 | |
| B. | KClO3和SO3溶于水后能导电,故KClO3和SO3是电解质 | |
| C. | 向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成 | |
| D. | 过量的铜与浓硝酸反应有NO生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com