
分析 I.(1)Na2CO3为强碱弱酸盐,在溶液中存在:CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-,溶液呈碱性;
(2)用Na2CO3溶液和Li2SO4溶液制Li2CO3,属于复分解反应,碳酸锂为沉淀,还是生成硫酸钠;
(3)碳酸锂在水中的溶解度很小且随温度升高而减小,应将反应后的物质加热后趁热过滤;
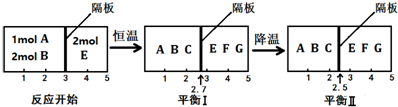
Ⅱ.(4)右室的混合物总物质的量不变,平衡(I)、平衡(Ⅱ)左右两室的温度、压强相同,体积之比等于物质的量之比,由图可知,平衡(I)降低温度达新平衡平衡(Ⅱ),隔板由2.7处移至2.5处,左室的气体的物质的量减小,降低温度平衡向正反应移动;
(5)右室中混合气体总物质的量不变,温度恒定,则达到平衡I时,体系压强与反应开始时体系压强之比等于体积之比;
(6)降低温度,右室的平衡一定移动,气体总的物质的量不变,E的含量一定变化;
(7)右室的混合物总物质的量不变为2mol,左右两室的压强、温度相等,同温同压下,体积之比等于物质的量之比,据此计算平衡(I)中左室混合气体总的物质的量,令参加反应的A的物质的量为amol,利用差量法计算a的值,再利用转化率定义计算A的转化率.
解答 解:I.(1)Na2CO3为强碱弱酸盐,在溶液中存在:CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-,溶液呈碱性,溶液中c(Na+)>c(CO32-),c(OH-)>c(H+),c(OH-)>c(HCO3-),碳酸氢根的水解程度远远小于碳酸根水解程度,碱性条件下水电离产生的氢离子浓度很小,溶液中c(HCO3-)>c(H+),故溶液中离子浓度:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+),
故答案为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+);
(2)用Na2CO3溶液和Li2SO4溶液制Li2CO3,属于复分解反应,碳酸锂为沉淀,还是生成硫酸钠,该反应方程式为:Na2CO3+Li2SO4=Li2CO3↓+Na2SO4 ,
故答案为:Na2CO3+Li2SO4=Li2CO3↓+Na2SO4 ;
(3)碳酸锂在水中的溶解度很小且随温度升高而减小,应将反应后的物质加热后趁热过滤,故选:b;
Ⅱ.(4)右室的混合物总物质的量不变,平衡(I)、平衡(Ⅱ)左右两室的温度、压强相同,体积之比等于物质的量之比,由图可知,平衡(I)降低温度达新平衡平衡(Ⅱ),隔板由2.7处移至2.5处,左室的气体的物质的量减小,降低温度平衡向正反应移动,降低温度平衡向放热反应移动,故该反应正反应为放热反应,
故答案为:放热;
(5)右室中混合气体总物质的量不变,温度恒定,则达到平衡I时,体系压强与反应开始时体系压强之比等于体积之比,即压强之比为2:(5-2.7)=20:23,
故答案为:20:23;
(6)降低温度,右室的平衡一定移动,气体总的物质的量不变,E的含量一定变化,平衡(I)和平衡(Ⅱ)中,E的体积分数一定不相等,
故答案为:不相等;
(7)右室的混合物总物质的量不变为2mol,左右两室的压强、温度相等,同温同压下,体积之比等于物质的量之比,平衡(I)中左室混合气体总的物质的量为$\frac{2.7}{2.3}$×2mol=$\frac{54}{23}$mol,令参加反应的A的物质的量为amol,则:
A(g)+2B(g)?2C(g) 物质的量减少△n
1 1
amol 3mol-$\frac{54}{23}$mol=$\frac{15}{23}$mol
解得a=$\frac{15}{23}$
所以A的转化率为$\frac{\frac{15}{23}mol}{1mol}$=$\frac{15}{23}$,
故答案为:$\frac{15}{23}$.
点评 本题属于拼合型题目,涉及考查元素化合物性质、常用化学用语书写、化学平衡移动与化学计算等,是对知识的综合运用,需要学生具备扎实的基础知识与运用知识分析问题、解决问题的能力,Ⅱ中清楚左右两室的温度、压强相同,体积之比等于物质的量之比是解题关键,难度中等.


 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温下,含1 mol Fe的铁片与过量浓HNO3反应,转移电子的数目为3 NA个 | |
| B. | 19.2 g铜与足量的稀硝酸反应产生NO的体积为4.48 L | |
| C. | 标准状况下,33.6 L SO3含有9.03×1023个SO3分子 | |
| D. | 在46 gNO2和N2O4的混合物气体中所含原子总数为3NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| T/℃ | 20 | 40 | 60 | 80 |
| S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6 g铁粉在0.1 mol氯气中充分燃烧,转移电子数为0.3 NA | |
| B. | 1 2.5 mL1 6 mol•L-1浓硫酸与足量铜反应,转移电子数为0.2 NA | |
| C. | 7.8 gNa2S和Na2O2 的混合物中含有的阴离子数等于0.1 NA | |
| D. | 0.5 mol氧单质含有NA个O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷与乙烷体积比是1:4 | B. | 丙炔与乙炔体积比是1:4 | ||
| C. | 乙烯与丁烷体积比是1:4 | D. | 乙烯与丁烯体积比是1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在使用过程中,电池负极区溶液的pH增大 | |
| B. | 在使用过程中,电子由Ag2O经外电路流向Zn极 | |
| C. | Zn是负极,Ag2O是正极 | |
| D. | Zn极发生还原反应,Ag2O极发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表中元素种类最多的周期是第6周期 | |
| B. | 第IA族元素均为碱金属元素 | |
| C. | 原子最外层电子数为2的元素一定位于第ⅡA族 | |
| D. | 元素周期表中元素种类最多的族是第Ⅷ族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
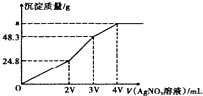 某混合溶液中含有溶质为NaCl、KI和Na2S各0.1mol,往该溶液在加入一定浓度的AgNO3溶液,产生沉淀的质量随加入AgNO3溶液的体积变化如图所示,则下列说法中不正确的是( )
某混合溶液中含有溶质为NaCl、KI和Na2S各0.1mol,往该溶液在加入一定浓度的AgNO3溶液,产生沉淀的质量随加入AgNO3溶液的体积变化如图所示,则下列说法中不正确的是( )| A. | 所加AgNO3溶液的物质的量浓度为$\frac{0.1}{V}mol•{L}^{-1}$ | |
| B. | a的数值为62.65 | |
| C. | 常温下,AgCl,AgI,AgS在水中溶解能力依次减小 | |
| D. | 在AgCl饱和溶液中加入NaI固体,有AgI沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | K+ Na+ NH+4 Fe2+ Ba2+ Cu2+ |
| 阴离子 | OH- I- NO3- AlO2- HCO3- HSO4- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com