
| A. | 常温下,含1 mol Fe的铁片与过量浓HNO3反应,转移电子的数目为3 NA个 | |
| B. | 19.2 g铜与足量的稀硝酸反应产生NO的体积为4.48 L | |
| C. | 标准状况下,33.6 L SO3含有9.03×1023个SO3分子 | |
| D. | 在46 gNO2和N2O4的混合物气体中所含原子总数为3NA个 |
分析 A、常温下铁在浓硝酸中发生钝化;
B.没有告诉在标准状况下,不能使用标况下的气体摩尔体积计算一氧化氮的体积;
C.标准状况下,三氧化硫的状态不是气体;
D.NO2和N2O4的最简式为NO2,根据最简式计算出混合气体中含有的原子数.
解答 解:A、常温下铁在浓硝酸中发生钝化,不能继续反应,电子转移不是3 NA个,故A错误;
B.19.2g铜的物质的量为0.3mol,0.3mol铜与足量的稀硝酸反应生成0.2molNO,不是标况下,不能使用标况下的气体摩尔体积计算一氧化氮的体积,故B错误;
C.标况下,三氧化硫不是气体,不能使用标况下的气体摩尔体积计算33.6L三氧化硫的物质的量,故C错误;
D.46g NO2和N2O4的混合物中含有1mol最简式NO2,含有1mol氮原子和2mol氧原子,总共含有3mol原子,混合物中原子总数为3NA个,故D正确;
故选D.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确标况下气体摩尔体积的使用条件,选项B为易错点,注意没有告诉在标准状况下.


科目:高中化学 来源: 题型:解答题
 工业上制取冰晶石(Na3AlF6)的化学方程式如下:2Al(OH)3+12HF+3A=2Na3AlF6+3CO2↑+9H2O 根据题意完成下列填空:
工业上制取冰晶石(Na3AlF6)的化学方程式如下:2Al(OH)3+12HF+3A=2Na3AlF6+3CO2↑+9H2O 根据题意完成下列填空: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 为测定含有Na2O杂质的Na2O2样品的纯度,甲同学设计以下的方案.用如图所示装置,通过测定Na2O2与C02反应生成02的体积来测定样品的纯度.
为测定含有Na2O杂质的Na2O2样品的纯度,甲同学设计以下的方案.用如图所示装置,通过测定Na2O2与C02反应生成02的体积来测定样品的纯度.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当人误食重金属盐类时,可以喝大量的牛奶、蛋清解毒 | |
| B. | 淀粉水解的最终产物可与新制的Cu(OH)2反应 | |
| C. | 蛋白质溶液中加入饱和硫酸铵溶液后产生的沉淀能重新溶于水 | |
| D. | 棉、麻、丝、毛完全燃烧只生成CO2和H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温时,某溶液中由水电离出来的c(H+)和c(OH-)的乘积为l×10-24,该溶液中一定可以大量存在K+、Na+、AlO2-、SO42- | |
| B. | 1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3NA | |
| C. | 在中和滴定实验中,既可用标准溶液滴定待测液,也可用待测液滴定标准溶液 | |
| D. | 某一反应体系中的物质有:HC1、SnCl2、H2SnCl6、As、H3AsO3、H2O,已知As是产物之一,则该反应配平后H2O的化学计量数为6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ② | C. | ③④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
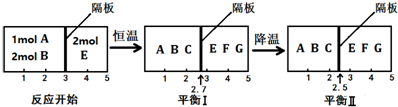
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com