
| A. | ①② | B. | ② | C. | ③④ | D. | ①④ |
分析 ①弱电解质部分电离,强电解质完全电离;
②酸的强弱与水溶性无关;
③20mL 1mol/LHCOOH与20mL 1mol/LNaOH恰好中和,强酸和氢氧化钠也是等物质的量恰好反应;
④强碱弱酸盐水解显碱性.
解答 解:①1mol•L-1 HCOOH若为强酸,完全电离氢离子浓度为1mol•L-1,pH值0,而实际pH为2,所以不能完全电离,为弱酸,故①选;
②酸的强弱与水溶性无关,故②不选;
③20mL 1mol/LHCOOH与20mL 1mol/LNaOH恰好中和,强酸和氢氧化钠也是等物质的量恰好反应,不能通过此判断酸的强弱,故③不选;
④HCOONa溶液的pH>7,说明甲酸钠存在水解,为强碱弱酸盐,可以证明甲酸为弱酸,故④选;
故选:D.
点评 本题考查弱电解质的实验方法设计,熟悉弱酸的性质及弱酸强碱盐的性质是解题关键,题目难度中等.


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 32 | B. | 67 | C. | 99 | D. | 166 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
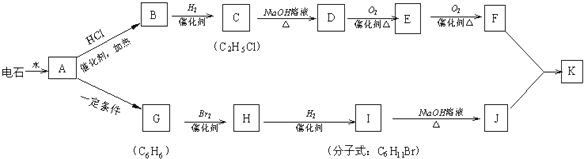
 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$ +NaBr;
+NaBr; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,含1 mol Fe的铁片与过量浓HNO3反应,转移电子的数目为3 NA个 | |
| B. | 19.2 g铜与足量的稀硝酸反应产生NO的体积为4.48 L | |
| C. | 标准状况下,33.6 L SO3含有9.03×1023个SO3分子 | |
| D. | 在46 gNO2和N2O4的混合物气体中所含原子总数为3NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在使用过程中,电池负极区溶液的pH增大 | |
| B. | 在使用过程中,电子由Ag2O经外电路流向Zn极 | |
| C. | Zn是负极,Ag2O是正极 | |
| D. | Zn极发生还原反应,Ag2O极发生氧化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com