
| A. | 常温时,某溶液中由水电离出来的c(H+)和c(OH-)的乘积为l×10-24,该溶液中一定可以大量存在K+、Na+、AlO2-、SO42- | |
| B. | 1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3NA | |
| C. | 在中和滴定实验中,既可用标准溶液滴定待测液,也可用待测液滴定标准溶液 | |
| D. | 某一反应体系中的物质有:HC1、SnCl2、H2SnCl6、As、H3AsO3、H2O,已知As是产物之一,则该反应配平后H2O的化学计量数为6 |
分析 A.常温时,某溶液中由水电离出来的c(H+)和c(OH-)的乘积为l×10-24,水的离子受到抑制,为酸或碱溶液;
B.Na2O中阳离子与阴离子之比为2:1,Na2O2中阴离子为过氧根离子,且阳离子与阴离子之比为2:1;
C.中和滴定时,酸可滴定碱,也可碱滴定酸;
D.根据As、Sn元素化合价及电子转移守恒可知,H3AsO3是氧化剂,被还原为As,SnCl2是还原剂被氧化为H2SnCl,再根据质量守恒、电子守恒书写方程式.
解答 解:A.常温时,某溶液中由水电离出来的c(H+)和c(OH-)的乘积为l×10-24,水的离子受到抑制,为酸或碱溶液,酸性溶液中不能大量存在AlO2-,故A错误;
B.Na2O中阳离子与阴离子之比为2:1,Na2O2中阴离子为过氧根离子,且阳离子与阴离子之比为2:1,则1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3NA,故B正确;
C.中和滴定时,酸可滴定碱,也可碱滴定酸,即中和滴定时可用标准溶液滴定待测液,也可用待测液滴定标准溶液,故C正确;
D.As是反应物之一,根据As、Sn元素化合价及电子转移守恒可知,H3AsO3是氧化剂,被还原为As,SnCl2是还原剂被氧化为H2SnCl,由电子守恒及原子守恒可知反应方程式为12HCl+3SnCl2+2H3AsO3═3H2SnCl6+2As+6H2O,该反应配平后H2O的化学计量数为6,故D正确;
故选A.
点评 本题考查较综合,涉及离子的共存、物质构成、中和滴定及氧化还原反应的配平等,注重高频考点的考查,把握反应原理为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
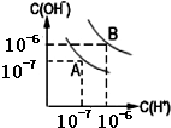 (1)室温下,在pH=12的NaCN溶液中,由水电离的c(OH-)为10-2 mol•L-1.
(1)室温下,在pH=12的NaCN溶液中,由水电离的c(OH-)为10-2 mol•L-1.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯既可使溴的四氯化碳溶液褪色,也可使酸性高锰酸钾溶液褪色 | |
| B. | 有机物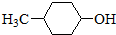 的消去产物有两种 的消去产物有两种 | |
| C. | 有机物C4H6O2能发生加聚反应,可推知其结构一定是CH2=CH-COOCH3 | |
| D. | 可用溴水鉴别苯酚、四氯化碳和乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
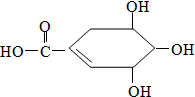 防治禽流感病毒是目前人类面临的一个重大课题.八角茴香属于草本植物,是我国民间常用做烹调的香料.医学研究成果显示,从八角茴香中可提取到莽草酸,莽草酸有抗炎、镇痛作用,也是合成对禽流感病毒有一定抑制作用的一种药物“达菲”的前体.莽草酸的结构式如图所示,下列关于莽草酸的说法正确的是( )
防治禽流感病毒是目前人类面临的一个重大课题.八角茴香属于草本植物,是我国民间常用做烹调的香料.医学研究成果显示,从八角茴香中可提取到莽草酸,莽草酸有抗炎、镇痛作用,也是合成对禽流感病毒有一定抑制作用的一种药物“达菲”的前体.莽草酸的结构式如图所示,下列关于莽草酸的说法正确的是( )| A. | 莽草酸的分子之间不能发生酯化反应 | |
| B. | 莽草酸的分子式为C7H10O5 | |
| C. | 莽草酸中含有苯环 | |
| D. | 莽草酸不能使溴水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,含1 mol Fe的铁片与过量浓HNO3反应,转移电子的数目为3 NA个 | |
| B. | 19.2 g铜与足量的稀硝酸反应产生NO的体积为4.48 L | |
| C. | 标准状况下,33.6 L SO3含有9.03×1023个SO3分子 | |
| D. | 在46 gNO2和N2O4的混合物气体中所含原子总数为3NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 甲 | 乙 | |
| 丙 | 丁 | 戊 |
| A. | 最高价氧化物对应的水化物的碱性:丙>丁>戊 | |
| B. | 金属性:甲>丙 | |
| C. | 原子半径:丙<丁<戊 | |
| D. | 最外层电子数:甲>乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷与乙烷体积比是1:4 | B. | 丙炔与乙炔体积比是1:4 | ||
| C. | 乙烯与丁烷体积比是1:4 | D. | 乙烯与丁烯体积比是1:4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com