
分析 (1)电解质是指:在水溶液中或熔融状态下能够导电的化合物;强电解质是在水溶液中或熔融状态下,能完全电离的电解质;包括强酸、强碱、活泼金属氧化物和大部分盐;弱电解质是在水溶液中不能完全电离的电解质,包括弱酸、弱碱、水等;非电解质是指:在熔融状态和水溶液中都不能导电的化合物,非电解质在熔融状态和水溶液中自身都不能离解出自由移动的离子;
(2)⑤CH3COOH 为弱酸在溶液中部分电离,⑥碳酸氢钠为强电解质,完全电离出钠离子和碳酸氢根离子.
解答 解:(1)①熔融氯化钠能完全电离出钠离子和氯离子,为化合物,属于强电解质;
②浓硫酸为硫酸的浓溶液为混合物,既不是电解质,也不是非电解质;
③Cu为单质,既不是电解质,也不是非电解质;
④蔗糖在熔融状态和水溶液中都只存在蔗糖分子,不能导电,为非电解质;
⑤CH3COOH在水溶液中部分电离:CH3COOH?CH3COO-+H+属于弱电解质;
⑥NaHCO3在水溶液中或熔融状态下能够完全电离,电离方程式为:NaHCO3═Na++HCO3-,属于强电解质;
⑦酒精水溶液中都只存在乙醇分子,不能导电,为非电解质;
⑧液溴为单质,既不是电解质,也不是非电解质;
故答案为:①⑥;④⑦;
(2)⑤CH3COOH 为弱酸在溶液中部分电离,电离出乙酸根离子和氢离子,电离方程式为:CH3COOH?CH3COO-+H+,⑥碳酸氢钠为强电解质完全电离出钠离子和碳酸氢根离子,电离方程式为:NaHCO3═Na++HCO3-,
故答案为:CH3COOH?CH3COO-+H+;NaHCO3═Na++HCO3-.
点评 本题考查了电解质与非电解质、强弱电解质的定义,侧重考查学生的辨别能力,注意明确电解质与非电解质的区别,单质和混合物既不是电解质,也不是非电解质,题目难度不大.


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 相对原子质量:Ar>K | B. | 碱性:NaOH>Mg(OH)2 | ||
| C. | 酸性:HNO3>H3PO4 | D. | 元素非金属性:Cl>S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④⑤⑥ | B. | ②③④⑥ | C. | ①③④⑤ | D. | ③④⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙炔的制备(蒸馏烧瓶、温度计、分液漏斗) | |
| B. | 蛋白质的盐析(试管、醋酸铅溶液、鸡蛋清溶液) | |
| C. | 蔗糖的水解(试管、蔗糖溶液、稀硫酸) | |
| D. | 肥皂的制取(蒸发皿、玻璃棒、甘油) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
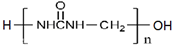 )可用于胶合板、刨花板等人造板材的生产及室内装修,但在使用过程中会释放出有毒物质,请写出合成该物质的单体的结构简式:CO(NH2)2、HCHO.
)可用于胶合板、刨花板等人造板材的生产及室内装修,但在使用过程中会释放出有毒物质,请写出合成该物质的单体的结构简式:CO(NH2)2、HCHO. )具有碱性.(选填“酸性”、“碱性”或“中性”)
)具有碱性.(选填“酸性”、“碱性”或“中性”)
 ,操作②的名称为重结晶.
,操作②的名称为重结晶. 转化为
转化为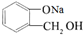 ,所选择的最佳试剂为H2O.
,所选择的最佳试剂为H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
| A | 纯盐酸 | 水煤气 | 硫酸 | 醋酸 | 干冰 |
| B | 冰醋酸 | 福尔马林 | 硫酸钡 | 亚硫酸 | 二氧化硫 |
| C | 油酯 | 淀粉 | 苛性钾 | 氢硫酸 | 碳酸钙 |
| D | 重水 | 纤维素 | 氯化钠 | 次氯酸 | 氯气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 共价键都有键能之说,键能是指拆开1mol共价键所需要吸收的能量或形成1mol共价键所放出的能量.
共价键都有键能之说,键能是指拆开1mol共价键所需要吸收的能量或形成1mol共价键所放出的能量.| 化学键 | H-H | H-F | H-Cl | H-Br |
| 键能/kJ/mol | 436 | 565 | 431 | 368 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性强弱:HIO4>HBrO4>HClO4 | B. | 碱性强弱:Ba(OH)2<Ca(OH)2<KOH | ||
| C. | 熔点:MgBr2<SiCl4<BN | D. | 沸点:PH3<NH3<H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述反应中,有两种离子化合物 | |
| B. | Mg3N2中,N3-的半径比Mg2+的半径大 | |
| C. | H2O与NH3含有相同的电子数,但H2O比NH3的稳定性差 | |
| D. | 碱性:Mg(OH)2>Al(OH)3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com