
| A. | 产生33.6L N2 | B. | 被还原的N原子为2mol | ||
| C. | 转移电子为4 mol | D. | 还原产物比氧化产物多0.5mol |
分析 由2N2H4+N2O4═3N2+4H2O可知,N2H4中N元素的化合价升高,N2O4中N元素的化合价降低,以此来解答.
解答 解:A、状况不知,所以体积不知,故A错误;
B、N2O4中N元素的化合价降低,被还原,所以反应消耗1mol N2H4,被还原的N原子为1mol,故B错误;
C、转移电子为4×2×0.5=4 mol,故C正确;
D、还原产物的物质的量为:0.5mol,氧化产物的物质的量为:1mol,所以还原产物比氧化产物少0.5mol,故D错误;
故选C.
点评 本题考查氧化还原反应知识,为高频考点,把握反应中元素化合价的变化为解答的关键,侧重氧化还原反应基本概念及分析与应用能力的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 澄清石灰水、浓H2SO4 | B. | 酸性KMnO4溶液、浓H2SO4 | ||
| C. | 溴水、浓H2SO4 | D. | 浓H2SO4、NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
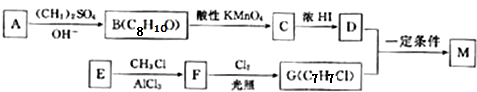
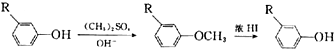
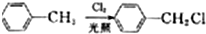
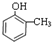 ;E→F的反应类型为取代反应;
;E→F的反应类型为取代反应;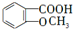 +
+ $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$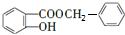 +HCl;
+HCl;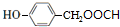 (写结构简式).
(写结构简式). 和(CH2)3CCl为起始原料制备
和(CH2)3CCl为起始原料制备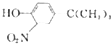 的合成路线
的合成路线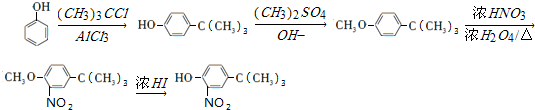 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
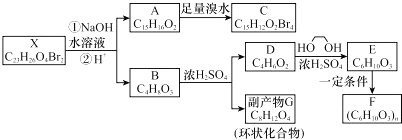
 ;
; ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
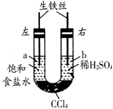 如图在盛有CCl4的U形管左右两端分别加入饱和食盐水和稀硫酸,使两边液面相平,再塞上插有铁丝的塞子,密封好,放置一段时间.下列说法错误的是( )
如图在盛有CCl4的U形管左右两端分别加入饱和食盐水和稀硫酸,使两边液面相平,再塞上插有铁丝的塞子,密封好,放置一段时间.下列说法错误的是( )| A. | 左右两边铁丝腐蚀速率一样快 | B. | 左右两边负极反应均为Fe-2e→Fe2+ | ||
| C. | 左边液面高于右边液面 | D. | 左右两边溶液的pH均升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取25gCuSO4•5H2O溶于1L水中 | |
| B. | 将CuSO4•5H2O干燥去掉结晶水,取16g溶于水制成1L溶液 | |
| C. | 将25gCuSO4•5H2O溶于水制成1L溶液 | |
| D. | 将12.5gCuSO4•5H2O溶于500mL水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中,Al3+、NH4+、SO42-、Br-可以大量共存 | |
| B. | 向该溶液中滴入少量NaOH溶液,发生反应的离子方程式:HCO3-+OH-═CO32-+H2O | |
| C. | 该溶液中,Na+、H+、Cl-、NO3-可以大量共存 | |
| D. | 向溶液中滴入过量BaCl2溶液,溶液的pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30 L | B. | 20 L | C. | 10 L | D. | 40 L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com