
【题目】(1)基态Fe2+离子有______个未成对电子,基态Ni原子的电子排布式为__________。
(2)用“>”或“<”填空:
第一电离能 | 熔点 | 酸性 |
Si_____S | NaCl______Si | H2SO4_____HClO4 |
(3)F2通入稀NaOH溶液中可生成OF2,OF2分子构型为_______。其中氧原子的杂化方式为_____。
(4)与H2O互为等电子体的一种阳离子为________(填化学式);
(5)Ni能与CO形成正四面体形的配合物Ni(CO)4,1mol Ni(CO)4中含有______molσ键。
(6)CaF2难溶于水,但可溶于含A13+的溶液中,原因是________(用离子方程式表示)。已知AlF63+溶液中可稳定存在。
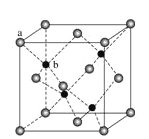
(7)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如图所示,其晶胞边长为540.0 pm,密度为_______(列式并计算),a位置S2-离子与b位置Zn2+离子之问的距离为_____pm(列式表示)
【答案】 4 [Ar]3d84s2 < < < V形 sp3 H2F+ 8 3CaF2+Al3+=3Ca2++AlF63- 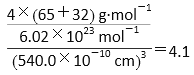
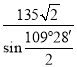 或
或![]()
【解析】(1)铁的原子序数是26,亚铁离子的核外电子排布式为1s22s2p63s23p63d6,因此基态Fe2+离子有4个未成对电子,Ni的原子序数是28,则基态Ni原子的电子排布式为[Ar]3d84s2。(2)同周期自左向右第一电离能逐渐增大,则第一电离能Si<S;氯化钠是离子晶体,硅是原子晶体,则熔点NaCl<Si;氯元素的非金属性强于硫元素,非金属性越强,最高价含氧酸的酸性越强,则酸性:H2SO4<HClO4。(3)OF2分子中中心原子的价层电子对数是![]() ,含有2对孤对电子,所以构型为V形,其中氧原子的杂化方式为sp3。(4)原子数和价电子数分别都相等的是等电子体,则与H2O互为等电子体的一种阳离子为 H2F+;(5)该配合物的配离子中Ni原子和C原子之间有4个σ键,CO分子中C和O之间存在1个σ键,1个π键,1个配位键,因此4个CO有4个σ键,故1mol Ni(CO)4中含有8molσ键;(6)由于AlF63+溶液中可稳定存在,因此可以发生反应3CaF2+Al3+=3Ca2++AlF63-,因此CaF2难溶于水,但可溶于含A13+的溶液中。(7)晶胞中含有白色球位于顶点和面心,共含有8×1/8+6×1/2=4,黑色球位于体心,共4个,则晶胞中平均含有4个ZnS,质量为4×(87÷6.02×1023)g,晶胞的体积为(540.0×10-10cm)3,则密度为
,含有2对孤对电子,所以构型为V形,其中氧原子的杂化方式为sp3。(4)原子数和价电子数分别都相等的是等电子体,则与H2O互为等电子体的一种阳离子为 H2F+;(5)该配合物的配离子中Ni原子和C原子之间有4个σ键,CO分子中C和O之间存在1个σ键,1个π键,1个配位键,因此4个CO有4个σ键,故1mol Ni(CO)4中含有8molσ键;(6)由于AlF63+溶液中可稳定存在,因此可以发生反应3CaF2+Al3+=3Ca2++AlF63-,因此CaF2难溶于水,但可溶于含A13+的溶液中。(7)晶胞中含有白色球位于顶点和面心,共含有8×1/8+6×1/2=4,黑色球位于体心,共4个,则晶胞中平均含有4个ZnS,质量为4×(87÷6.02×1023)g,晶胞的体积为(540.0×10-10cm)3,则密度为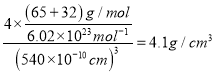 ;b位置黑色球与周围4个白色球构成正四面体结构,a位置白色球与黑色球b的连线处于晶胞体对角线上,其距离为晶胞体对角线长度的1/4,而体对角线长度为晶胞棱长的
;b位置黑色球与周围4个白色球构成正四面体结构,a位置白色球与黑色球b的连线处于晶胞体对角线上,其距离为晶胞体对角线长度的1/4,而体对角线长度为晶胞棱长的![]() 倍,故a位置S2-离子与b位置Zn2+离子之间的距离为
倍,故a位置S2-离子与b位置Zn2+离子之间的距离为![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. BaSO4溶于水的部分能够电离,所以BaSO4是电解质
B. SO2的水溶液能够导电,所以SO2是电解质
C. 液态Cl2不导电,所以Cl2是非电解质
D. 液态HCl不导电,所以HCl是非电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式的是( )
A.Ca(HCO3)2溶液与过量NaOH溶液反应:HCO![]() +Ca2++OH-===CaCO3↓+H2O
+Ca2++OH-===CaCO3↓+H2O
B.等物质的量的MgCl2、Ba(OH)2和HCl溶液混合:Mg2++2OH-===Mg(OH)2↓
C.铜溶于稀硝酸中:Cu+4H++2NO![]() ===Cu2++2NO2↑+2H2O
===Cu2++2NO2↑+2H2O
D.FeBr2溶液中通入少量的Cl2:2Fe2++Cl2===2Fe3++2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关认识正确的是 ( )
A. 同一能层的所有电子的能量均相等
B. 各能层的能级都是从s能级开始至f能级结束
C. 各能层含有的能级数为n-1
D. 各能层最多容纳的电子数为2n2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中错误的是( )
A.离子晶体在熔化状态下能导电
B.在晶体中只要有阴离子就一定有阳离子
C.原子晶体中一定有非极性共价键
D.分子晶体中不一定含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学原理在防止金属腐蚀、能量转换、物质合成等方面应用广泛。

(1)图1中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择__________(填字母序号)
a.碳棒 b.锌板 c.铜板
用电化学原理解释材料B需定期拆换的原因_______________。


(2)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。图2为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。
①E为该燃料电池的_____________极(填“正”或“负”)。F电极上的电极反应式为_____________。
②镁燃料电池负极容易发生自腐蚀产生氢气,使负极利用率降低,用化学用语解释其原因____________。
(3)乙醛酸(HOOC-CHO)是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸,原理如图3所示,该装置中阴、阳两极为惰性电极,两级室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸。
①N电极上的电极反应式为______________。
②若有2molH+通过质子交换膜,并完全参与了反应,则该装置中生成的乙醛酸为________________mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com