
【题目】下列说法中错误的是( )
A.离子晶体在熔化状态下能导电
B.在晶体中只要有阴离子就一定有阳离子
C.原子晶体中一定有非极性共价键
D.分子晶体中不一定含有共价键
科目:高中化学 来源: 题型:
【题目】要证明某溶液中不含有Fe3+而可能含有Fe2+,进行如下实验操作时最佳顺序为( )
①加入足量氯水 ②加入足量KMnO4溶液 ③加入少量KSCN溶液
A. ①③ B. ②③
C. ③① D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)基态Fe2+离子有______个未成对电子,基态Ni原子的电子排布式为__________。
(2)用“>”或“<”填空:
第一电离能 | 熔点 | 酸性 |
Si_____S | NaCl______Si | H2SO4_____HClO4 |
(3)F2通入稀NaOH溶液中可生成OF2,OF2分子构型为_______。其中氧原子的杂化方式为_____。
(4)与H2O互为等电子体的一种阳离子为________(填化学式);
(5)Ni能与CO形成正四面体形的配合物Ni(CO)4,1mol Ni(CO)4中含有______molσ键。
(6)CaF2难溶于水,但可溶于含A13+的溶液中,原因是________(用离子方程式表示)。已知AlF63+溶液中可稳定存在。
(7)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如图所示,其晶胞边长为540.0 pm,密度为_______(列式并计算),a位置S2-离子与b位置Zn2+离子之问的距离为_____pm(列式表示)
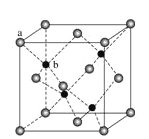
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将20.0g质量分数为14.0%的KNO3溶液跟30.0g质量分数为24.0%的KNO3溶液混合,得到的密度为1.15g·cm-3的混合溶液。计算:
(1)混合后溶液的质量分数___________。
(2)混合后溶液的物质的量浓度_____________。
(3)在1000g水中需溶解_____________摩尔KNO3才能使其浓度恰好与上述混合后溶液的浓度相等?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
①CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH1=-870.3 kJ·mol-1
②C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ·mol-1
③H2(g) +![]() O2(g)===H2O(l)
O2(g)===H2O(l)
ΔH3=-285.8 kJ·mol-1
则反应2C(s)+2H2(g)+O2(g)===CH3COOH(l)的ΔH为( )
A. -488.3 kJ·mol-1 B. -244.15 kJ·mol-1
C. 488.3 kJ·mol-1 D. 244.15 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表前四周期的一部分,下列叙述正确的是( )

A. Y单质在空气中燃烧生成YO3
B. Z元素的最高价氧化物的水化物酸性最强
C. X的氢化物为H2X
D. Y、Z和W的阴离子半径依次增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示,判断下列叙述中正确的是( )
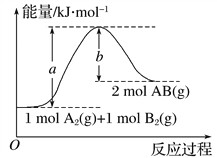
A. 断裂1 mol A—A和1 mol B—B键,放出a kJ能量
B. 每生成2 mol AB(g)吸收b kJ能量
C. 该反应中反应物的总能量高于生成物的总能量
D. 该反应热ΔH=(a-b) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,A是可用来对自来水进行消毒的黄绿色单质气体,A、B、C、D、E 都含X元素,其转化关系如下图所示。
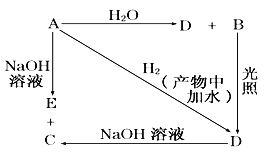
(1)请分别写出A、B、C、D、E的化学式(如为溶液请填溶质的化学式):
A _____,B _____,C ______,D_____,E___________。
(2)写出下列反应的化学方程式:
A+H2O:______________;
A+NaOH:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学活动课上,三组学生分别用图示甲、乙两装置,探究“NaHCO3和Na2CO3与稀盐酸的反应”,按表中的试剂用量,在相同条件下,将两个气球中的固体粉末同时倒入试管中(装置的气密性良好)。请回答:
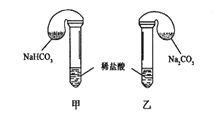
(1)各组反应开始时,____________(甲、乙)装置中的气球体积先变大,该装置中反应的化学反应方程式是_____________。
(2)当试管中不再有气体生成时,三组实验出现不同现象,试分析原因并填写下表的空格。
试剂用量 | 实验现象 (气球体积变化) | 分析原因 | |
第①组 | 0.42gNaHCO3 0.53gNa2CO3 3mL 4mol·L-1盐酸 | 甲中气球与乙中气球的体积相等 | 甲、乙盐酸均过量 n(NaHCO3)= n(Na2CO3) V甲(CO2)= V乙(CO2) |
第②组 | 0.3gNaHCO3 0.3gNa2CO3 3mL 4 mol·L-1盐酸 | 甲中气球比乙中气球的体积大 | A:___________ |
第③组 | 0.6gNaHCO3 0.6gNa2CO3 3mL 2 mol·L-1盐酸 | 甲中气球比乙中气球的体积大 | B:______________ |
片刻后,乙中气球又缩小,甲中气球的体积基本不变 | (用化学方程式表示) C:___________ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com