
【题目】图中是生物体内几种有机物组成以及它们各自功能的关系图,m1、m2、m3、m4分别是大分子物质M1、M2、M3、M4的组成单位。下列说法正确的是( )

A. 相同质量的M1和M2被彻底氧化分解,则M1的耗氧量多
B. 同一个体不同细胞中M3的种类不同取决于基因的选择性表达
C. m3和m4之间的区别主要是五碳糖和碱基的种类不同
D. 不同的M4在结构上的区别主要是m4的连接方式不同
【答案】B
【解析】试题分析:阅读题干和题图可知,本题是糖类、脂肪、蛋白质、核酸的元素组成、基本单位和功能,分析题图,M1是糖类,其基本单位m1是葡萄糖,元素组成是C、H、O;M2是脂肪,其基本单位m2是甘油和脂肪酸,元素组成是C、H、O;M3是蛋白质,其基本单位m3是氨基酸,元素组成是C、H、O、N(s);M4是核酸,其基本单位m4是核苷酸,元素组成是C、H、O、N、P.
解:A、M1是糖类,M2是脂肪,相同质量的M1和M2,M1中H的相对含量少,耗氧量少,A错误;
B、M3是蛋白质,同一一个体不同细胞中M3的种类不同是基因选择表达的结果,B正确;
C、m3是氨基酸,是蛋白质的基本单位,m4是核苷酸,是核酸的基本单位,五碳糖和碱基的种类不同不是m3和m4之间的区别,是DNA与RNA之间的区别,C错误;
D、M4是核酸,不同的M4在结构上的区别主要是核苷酸的排列顺序不同,D错误.
故选:B.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】科学家对一碳化学进行了广泛深入的研究并取得了一些重要成果。
(1)已知:CO(g)+2H2(g)![]() CH3OH(g) ΔH1=-90.1kJ·mol-1;
CH3OH(g) ΔH1=-90.1kJ·mol-1;
3CH3OH(g)![]() CH3CH=CH2(g)+3H2O(g) ΔH2=-31.0 kJ·mol-1。
CH3CH=CH2(g)+3H2O(g) ΔH2=-31.0 kJ·mol-1。
CO与H2合成CH3CH=CH2的热化学方程式为______________________________________。
(2)现向三个体积均为2L的恒容密闭容器Ⅰ、Ⅱ、Ⅲ中,均分别充入1molCO和2molH2,发生反应:CO(g)+2H2(g)![]() CH3OH(g) ΔH=-90.1kJ·mol-1。三个容器的反应温度分别为T1、T2、T3且恒定不变。当反应均进行到5min时H2的体积分数如图1所示,其中只有一个容器中的反应已经达到平衡状态。
CH3OH(g) ΔH=-90.1kJ·mol-1。三个容器的反应温度分别为T1、T2、T3且恒定不变。当反应均进行到5min时H2的体积分数如图1所示,其中只有一个容器中的反应已经达到平衡状态。
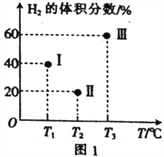
①5min时三个容器中的反应达到化学平衡状态的是容器_____________(填序号)。
②0~5min内容器Ⅰ中用CH3OH表示的化学反应速率v(CH3OH)=_________________。
③当三个容器中的反应均达到平衡状态时,CO的转化率最高的是容器____________(填序号,下同);平衡常数最小的是容器____________________。
(3)CO常用于工业冶炼金属,在不同温度下用CO还原四种金属氧化物,达到平衡后气体中lg![]() 与温度(T)的关系如图2所示。下列说法正确的是_____________(填字母)。
与温度(T)的关系如图2所示。下列说法正确的是_____________(填字母)。
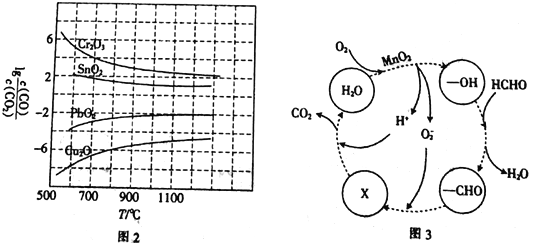
a.工业上可以通过增高反应装置来延长矿石和CO接触的时间,减少尾气中CO的含量
b.CO用于工业冶炼金属铬(Cr)时,还原效率不高
c.工业冶炼金属铜(Cu)时,600℃下CO的利用率比100℃下CO的利用率更大
d.CO还原PbO2反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关下图中有机物的说法不正确的是
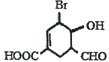
A. 该有机物的分子式为C8H9O4Br
B. 1mol该有机物最多可以与3molH2反应
C. 能发生酯化反应、水解反应、银镜反应和缩聚反应
D. 1mol该有机物与NaOH溶液反应时,最多消耗2molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分类合理的是( )
A.酸性氧化物:SO2、SO3、CO2、CO
B.碱:烧碱、纯碱、苛性钾、氢氧化钡
C.混合物:铝热剂、漂白粉、水煤气、氢氧化铁胶体
D.电解质:稀硫酸、氢氧化钠、氯化钠、MgO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是生物体内四种有机物的组成与功能关系图,有关叙述错误的是

A. 小麦种子细胞中,物质A是葡萄糖,物质E是淀粉
B. 相同质量的E和F彻底氧化分解,释放能量较多的是F
C. 物质C的种类约有20种,基本组成元素是C、H、O、N
D. SARS病毒的物质H彻底水解后,产物是CO2和H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校学生小红利用右下图装置合成乙酸乙酯的步骤如下:在圆底烧瓶A 内加入乙醇,浓硫酸和乙酸,瓶口竖直安装仪器B,加热回流一段时间后换成蒸馏装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品。请回答下列问题:

(1)仪器B的名称为_____,冷凝水的流入方向是_______________(填“a”或“b”)。
(2)在烧瓶中放入碎瓷片,其作用是___________________;如果加热一段时间后发现忘记添加碎瓷片,应该采取的正确操作是___________(填字母)。
A.冷却后补加 B.立即补加 C.不需补加 D.重新配料后加入
(3)反应中加入过量乙醇,其目的是___________________。加入数滴浓硫酸即能起催化作用,但实际用量多于此量,原因是______________;浓硫酸用量又不能过多,原因是________________________。
(4)如果将上述实验步骤改为在蒸馏烧瓶内先加入乙醇和浓硫酸,然后通过分液漏斗边滴加乙酸,边加热蒸馏。这样操作可以提高酯的产率,其原因是__________________________________。
(5)甲、乙两位同学欲将所得含有乙醇、乙酸和水的乙酸乙酯粗产品提纯。他们分别将粗产品与一定量NaOH溶液混合后,蒸馏收集76℃~78℃的产品(已知:乙醇的沸点78℃,乙酸的沸点117.9℃,乙酸乙酯的沸点77℃)。实验结果:甲得到溶于水的液体X;乙得到难溶于水。但显酸性的液体Y;则:①X主要含_________________________。②Y主要_________________________。__________________________。
(6)丙同学重新设计了提纯粗产品的方案,流程如下:

由此回答下列问题:
①试剂a是:_______________ ,其作用是溶解乙醇、反应消耗乙酸和____________________。
②分离方法[Ⅰ]是_____________,试剂b是___________,分离方法[Ⅱ]是_____________。
(7)用30g乙酸与46g乙醇反应,产率为67%,则制得的乙酸乙酯的质量为__________g(保留3位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中由于哑铃形的C22﹣存在,使晶胞沿一个方向拉长.下列关于CaC2晶体的说法中正确的是( )

A. 1 个 Ca2+周围距离最近且等距离的 C22﹣数目为 6
B. 该晶体中的阴离子与F2是等电子体
C. 6.4 g CaC2晶体中含阴离子0.1 mol
D. 与每个Ca2+距离相等且最近的Ca2+共有12个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验室需要480mL,0.5mol/L的稀硫酸,现欲用98%的浓硫酸(ρ=1.84g/cm3 )配制,配制步骤包括:①计算所用浓硫酸的体积②转移③定容、上下颠倒摇匀④量取一定体积的浓硫酸⑤洗涤并转移⑥稀释并冷却至室温⑦轻摇混匀。完成下列问题:
(1)正确的操作顺序为(填入序号)________。选用的主要仪器有:量筒、烧杯、玻璃棒、________、________。
(2)应量取浓硫酸的体积为________;量取浓硫酸所用的量筒的规格是________(从下列中选用,填字母 A.10 mL B.25 mL C.50 mL D.100 mL);第⑥步中稀释实验的操作方法是________。
(3)下列关于容量瓶的使用方法中,正确的是________。
A.使用前要检验是否漏水
B.在容量瓶中直接溶解固体或稀释液体
C.溶液未经冷却即注入容量瓶中
D.向容量瓶中转移溶液要用玻璃棒引流
(4)下列情况中,所配制的稀硫酸浓度偏大的是________。
A.所用的浓硫酸长时间放置在密封不好的容器中
B.容量瓶用蒸馏水洗涤后残留有少量的水
C.所用过的烧杯、玻璃棒未洗涤
D.定容时俯视刻度线
E.用量筒量取浓硫酸时仰视刻度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:X+Y=M+N为放热反应,对该反应的下列说法中正确的是( )
A.X的能量一定高于M
B.Y的能量一定高于N
C.X和Y的总能量一定高于M和N的总能量
D.因为该反应为放热反应,故不必加热反应就可以发生
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com