
����Ŀ����ѧ�Ҷ�һ̼��ѧ�����˹㷺������о���ȡ����һЩ��Ҫ�ɹ���
��1����֪��CO(g)+2H2(g)![]() CH3OH(g) ��H1=-90.1kJ��mol-1��
CH3OH(g) ��H1=-90.1kJ��mol-1��
3CH3OH(g)![]() CH3CH=CH2(g)+3H2O(g) ��H2=-31.0 kJ��mol-1��
CH3CH=CH2(g)+3H2O(g) ��H2=-31.0 kJ��mol-1��
CO��H2�ϳ�CH3CH=CH2���Ȼ�ѧ����ʽΪ______________________________________��
��2���������������Ϊ2L�ĺ����ܱ��������������ֱ����1molCO��2molH2��������Ӧ��CO(g)+2H2(g)![]() CH3OH(g) ��H=-90.1kJ��mol-1�����������ķ�Ӧ�¶ȷֱ�ΪT1��T2��T3�Һ㶨���䡣����Ӧ�����е�5minʱH2�����������ͼ1��ʾ������ֻ��һ�������еķ�Ӧ�Ѿ��ﵽƽ��״̬��
CH3OH(g) ��H=-90.1kJ��mol-1�����������ķ�Ӧ�¶ȷֱ�ΪT1��T2��T3�Һ㶨���䡣����Ӧ�����е�5minʱH2�����������ͼ1��ʾ������ֻ��һ�������еķ�Ӧ�Ѿ��ﵽƽ��״̬��
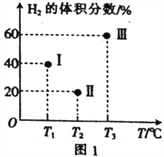
��5minʱ���������еķ�Ӧ�ﵽ��ѧƽ��״̬��������_____________�����������
��0~5min������������CH3OH��ʾ�Ļ�ѧ��Ӧ����v(CH3OH)=_________________��
�������������еķ�Ӧ���ﵽƽ��״̬ʱ��CO��ת������ߵ�������____________�����������ͬ����ƽ�ⳣ����С��������____________________��
��3��CO�����ڹ�ҵұ���������ڲ�ͬ�¶�����CO��ԭ���ֽ������������ﵽƽ���������lg![]() ���¶���T���Ĺ�ϵ��ͼ2��ʾ������˵����ȷ����_____________������ĸ����
���¶���T���Ĺ�ϵ��ͼ2��ʾ������˵����ȷ����_____________������ĸ����
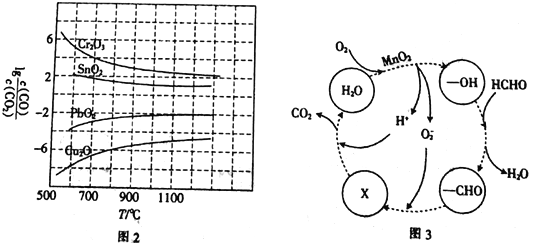
a.��ҵ�Ͽ���ͨ�����߷�Ӧװ�����ӳ���ʯ��CO�Ӵ���ʱ�䣬����β����CO�ĺ���
b.CO���ڹ�ҵұ��������(Cr)ʱ����ԭЧ�ʲ���
c.��ҵұ������ͭ(Cu)ʱ��600����CO�������ʱ�100����CO�������ʸ���
d.CO��ԭPbO2��Ӧ����H>0
���𰸡� 3CO(g)+6H2(g)![]() CH3CH=CH2(g)+3H2O(g) ��H=-301.3kJ��mol-1 �� 0.067mol��L-1��min-1(��
CH3CH=CH2(g)+3H2O(g) ��H=-301.3kJ��mol-1 �� 0.067mol��L-1��min-1(��![]() mol��L-1��min-1) �� �� bc
mol��L-1��min-1) �� �� bc
����������1�����⿼���Ȼ�ѧ��Ӧ����ʽ�ļ��㣬��CO(g)+2H2(g)![]() CH3OH(g) ����3CH3OH(g)
CH3OH(g) ����3CH3OH(g)![]() CH3CH=CH2(g)+3H2O(g) ���١�3���ڣ��ó���3CO(g)+6H2(g) CH3CH=CH2(g)+3H2O(g) ��H=��301.3kJ��mol��1����2�����⿼�黯ѧƽ��״̬���жϡ���������ԭ������ѧƽ�ⳣ������I��II���������������С��˵����Ӧ������Ӧ������У�û�дﵽ��ѧƽ�⣬��III�����������������˵�������¶ȣ�ƽ�����淴Ӧ������У�III�ﵽƽ�⣻��
CH3CH=CH2(g)+3H2O(g) ���١�3���ڣ��ó���3CO(g)+6H2(g) CH3CH=CH2(g)+3H2O(g) ��H=��301.3kJ��mol��1����2�����⿼�黯ѧƽ��״̬���жϡ���������ԭ������ѧƽ�ⳣ������I��II���������������С��˵����Ӧ������Ӧ������У�û�дﵽ��ѧƽ�⣬��III�����������������˵�������¶ȣ�ƽ�����淴Ӧ������У�III�ﵽƽ�⣻��
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
��ʼ�� 1 2 0
�仯�� x 2x x
5min��1��x 2��2x x I�����е��������������Ϊ40%�������(2��2x)/(3��2x)��100%=40%����x=2/3mol�����ݻ�ѧ��Ӧ���ʵ���ѧ����ʽ��v(CH3OH)=2/(3��5��2)mol/(L��min)=1/15mol/(L��min)���۴˷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ�����COת������ߵ�������I��ƽ�ⳣ��ֻ���¶ȵ�Ӱ�죬�¶����ߣ�ƽ�����淴Ӧ������У���ѧƽ�ⳣ����С����˻�ѧƽ�ⳣ����С����III����3�����⿼�黯ѧͼ��a�����ߣ��ӳ���ʯ��CO�Ӵ���ʱ�䣬�Ի�ѧƽ���ƶ���Ӱ�죬CO�������ʲ��ͣ���a����b����ͼ���֪��CO��ҵұ��������ʱ��lg![]() һֱ�ܸߣ�˵��COת���ʺܵͣ���b��ȷ��c����ͼ���֪���¶�Խ�ͣ�lg
һֱ�ܸߣ�˵��COת���ʺܵͣ���b��ȷ��c����ͼ���֪���¶�Խ�ͣ�lg![]() ԽС��COת����Խ�ߣ���c��ȷ��d����ͼ���֪CO��ԭPbO2���¶�Խ��lg
ԽС��COת����Խ�ߣ���c��ȷ��d����ͼ���֪CO��ԭPbO2���¶�Խ��lg![]() Խ�ߣ�˵��COת����Խ�ͣ�ƽ�������ƶ�����H<0����d����
Խ�ߣ�˵��COת����Խ�ͣ�ƽ�������ƶ�����H<0����d����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڻ���ƽ�����װ�л�ԭ����(N2H4)��ǿ������H2O2�������ǻ��ʱ�������������ĵĵ�����ˮ���������ų���������������֪0.4molҺ̬�º�����˫��ˮ��Ӧ���ɵ�����ˮ����ʱ�ų�256.65KJ��������
��1��д���º�������Ľṹʽ��_______����������_________��
��2��������ӦӦ���ڻ���ƽ��������ͷų����������Ϳ��ٲ������������⣬����һ����ͻ�����ŵ���______��
��3��д���º�˫��ˮ��Ӧ���Ȼ�ѧ����ʽ___________��
��4����֪H2O��l���TH2O��g������H=+44KJ/mol����16gҺ̬��������˫��ˮ��Ӧ���ɵ�����Һ̬ˮʱ���ų���������_________��
��5����֪��
N2��g��+2O2��g��=2NO2��g����H=+67.7kJ/mol
N2H4��g��+O2��g��=N2��g��+2H2O��g����H=-543kJ/mol
������NO2��ȫ��Ӧ���Ȼ�ѧ����ʽΪ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����е��뷽��ʽ�У�����ȷ���ǣ� ��
A.HCl�TH++Cl��
B.NH3H2O�TNH4++OH��
C.CaCl2=Ca2++2Cl��
D.CH3COOHCH3COO��+H+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״���һ����Ҫ�Ļ���ԭ�ϣ�����һ�ֿ�������Դ�����п�����Ӧ�õĹ���ǰ����
(1)��֪��CH3OH(g)===HCHO(g)��H2(g) ��H����84 kJ��mol��1
2H2(g)��O2(g)===2H2O(g) ��H����484 kJ��mol��1
�ٹ�ҵ�ϳ��Լ״�Ϊԭ����ȡ��ȩ����д��CH3OH(g)��O2(g)��Ӧ����HCHO(g)��H2O(g)���Ȼ�ѧ����ʽ��______________________________________________��
���������Ʊ���ȩʱ������Ӧ����ͨ���ʵ���������������Ŀ��_________________��
(2)��ҵ�Ͽ������·����ϳɼ״�����ѧ����ʽΪCO(g)��2H2(g)==CH3OH(g)����֪ijЩ��ѧ���ļ����������±���
��ѧ�� | C��C | C��H | H��H | C��O | C��O | O��H |
����/(kJ��mol��1) | 348 | 413 | 436 | 358 | x | 463 |
��ش��������⣺
��ͼ1������a������b�Ĵ�ʩ��_________��

����֪CO�е�C��O֮��Ϊ�����������Ϊx kJ/mol����x��________��
(3)�ɼ״���������NaOH��Һ���ɵ������ֻ���أ���ʹ�ֻ�����ʹ��һ���²ų�һ�ε硣
�ٸõ�ظ����ĵ缫��ӦʽΪ______________________________________��
�����Ըõ��Ϊ��Դ����ʯī���缫���200 mL�����������ӵ���Һ��
���� | Cu2�� | H�� | Cl�� | SO42�� |
c/(mol��L��1) | 0.5 | 2 | 2 | 0.5 |
���һ��ʱ��������ռ�����ͬ���(��ͬ������)������ʱ(������Һ����ı仯���缫������ܴ��ڵ��ܽ�����)�������ռ�������������Ϊ________��
(4)���ˮ������CO2�����ϳ���(H2
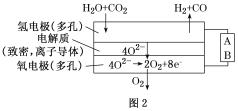
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ������������ԭ��Ӧ���������ȷ�Ӧ����
A. ϡ�������������Ƶķ�Ӧ B. �����������е�ȼ�շ�Ӧ
C. NH4Cl��Ba(OH)2��8H2O��Ӧ D. ���ȵ�̼��CO2�ķ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. ����ʱ��0.1mol��L-1��������Һ��NH4Al(SO4)2 ��NH4Cl ��NH3��H2O ��CH3COONH4 �У�c (NH4+)�ɴ�С��˳���ǣ���>��>��>��
B. 0.1mol��L-1 NaHCO3��Һ�У�c(Na+)= 2c(CO32-)+ c(HCO3-)+c(H2CO3)
C. ����ʱ��pH=2��CH3COOH��Һ��HCl��Һ��pH=12�İ�ˮ��NaOH��Һ��������Һ����ˮ�����c(H+)�����
D. ����ʱ��0.3 mol��L-1HY��Һ��0.3 mol��L-1NaOH��Һ�������Ϻ���Һ��pH=9��������Һ��c(H+) +c(HY)= 1��10-5 mol��L-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ʵ���˵������ȷ���ǣ�
���� | ���� |
| ��ͭƬ�ܽ⣬��Һ��������ʼ��������ɫ���壬������ɫ�䵭��ֱ����ɫ���ڹܿڴ���Ϊ����ɫ ��ͭƬ�����ܽ⣬������ɫ���壬�ڹܿڴ���Ϊ����ɫ |
A. ʵ���в�������ɫ���壬˵��ŨHNO3����������
B. ������ʵ������У������ķ�Ӧ����2��
C. ���в�����ɫ���壬˵��������������
D. ����ͭƬ������Ƭ�������û������ʵ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ̽��Ӱ�컯ѧ��Ӧ���ʵ����أ���25mL 5%��H2O2��Һ�У���������������������������ʱ��������ʱ����̵��ǣ�
��� | V(1mol/L FeCl3)/mL | ����ˮ/mL | �¶�/�� |
A | 2 | 2 | 50 |
B | 3 | 1 | 40 |
C | 2 | 2 | 40 |
D | 3 | 1 | 50 |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͼ�����������ڼ����л�������Լ����Ǹ��Թ��ܵĹ�ϵͼ��m1��m2��m3��m4�ֱ��Ǵ��������M1��M2��M3��M4����ɵ�λ������˵����ȷ����( )

A. ��ͬ������M1��M2�����������ֽ⣬��M1�ĺ�������
B. ͬһ���岻ͬϸ����M3�����ͬȡ���ڻ����ѡ���Ա���
C. m3��m4֮���������Ҫ����̼�Ǻͼ�������ͬ
D. ��ͬ��M4�ڽṹ�ϵ�������Ҫ��m4�����ӷ�ʽ��ͬ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com