
| A.C2H4和C2H6 | B.C2H2和C3H8 | C.C2H6和C3H8 | D.C2H6和CH4 |
 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源:不详 题型:单选题
| A.1 :1 | B.2 :1 | C.2 :3 | D.1 :3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 O2(g)=H2O(l) △H=-285.84kJ·mol-1
O2(g)=H2O(l) △H=-285.84kJ·mol-1 查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 H=" -198" kJ·mol-1反应过程的能量变化如图所示。请回答下列问题:
H=" -198" kJ·mol-1反应过程的能量变化如图所示。请回答下列问题:
 H= kJ·mol-1;
H= kJ·mol-1; 查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 O2(g)
O2(g)  SO3(g) △H =" ―98.32" kJ·mol-1,在容器中充入2molSO2 和1molO2充分反应,最终放出的热量为
SO3(g) △H =" ―98.32" kJ·mol-1,在容器中充入2molSO2 和1molO2充分反应,最终放出的热量为| A.196.64 kJ | B.196.64 kJ·mol-1 | C.<196.64 kJ | D.>196.64 kJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.194 | B.516 | C.391 | D.658 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2SO3(g)反应过程的能量变化如图所示。请回答下列问题:
2SO3(g)反应过程的能量变化如图所示。请回答下列问题: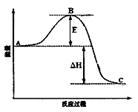
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 O2(g)==H2O(l) △H3= -285 kJ·mol-1
O2(g)==H2O(l) △H3= -285 kJ·mol-1| A.—243.5 kJ·mol-1 | B.—487 kJ·mol-1 | C.—1113.5 kJ·mol-1 | D.—2227 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.有10NA个电子转移时,该反应吸收1300kJ的能量 |
| B.有NA个水分子生成且为液态时,吸收1300kJ的能量 |
| C.有NA个碳氧共用电子对形成时,放出1300kJ的能量 |
| D.有8NA个碳氧共用电子对形成时,放出1300kJ的能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com