
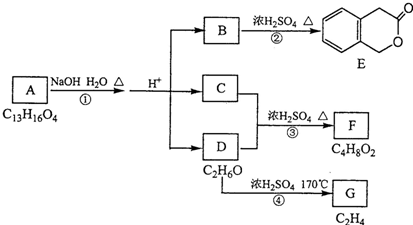
 .反应①的反应类型是水解反应或取代反应.
.反应①的反应类型是水解反应或取代反应. .
. .
.分析 B在浓硫酸加热条件下生成E,由E的结构可知,B发生酯化反应生成E,故B为 ;D的分子式为C2H6O,一定条件下可以生成C2H4,故D为CH3CH2OH,G为CH2=CH2;
;D的分子式为C2H6O,一定条件下可以生成C2H4,故D为CH3CH2OH,G为CH2=CH2;
C与CH3CH2OH在浓硫酸、加热条件下生成F,结合F的分子式C4H8O2可知,生成F的反应为酯化反应,故C为CH3COOH,F为CH3COOCH2CH3,A在氢氧化钠水溶液、加热条件下发生水解反应,酸化得到B、C、D,故A为
(6)乙烯与溴发生加成反应生成1,2-二溴乙烷,1-2二溴乙烷在氢氧化钠水溶液、加热条件下发生水解反应生成乙二醇,据此解答.
解答 解:B在浓硫酸加热条件下生成E,由E的结构可知,B发生酯化反应生成E,故B为 ;D的分子式为C2H6O,一定条件下可以生成C2H4,故D为CH3CH2OH,G为CH2=CH2;
;D的分子式为C2H6O,一定条件下可以生成C2H4,故D为CH3CH2OH,G为CH2=CH2;
C与CH3CH2OH在浓硫酸、加热条件下生成F,结合F的分子式C4H8O2可知,生成F的反应为酯化反应,故C为CH3COOH,F为CH3COOCH2CH3,A在氢氧化钠水溶液、加热条件下发生水解反应,酸化得到B、C、D,故A为
(1)D结构简式为CH3CH2OH,名称是乙醇,故答案为:乙醇;
(2)该反应为乙醇和乙酸的酯化反应,反应方程式为CH3COOH+C2H5OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O,
故答案为:CH3COOH+C2H5OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O;
(3)B的分子式是C9H10O3,A的结构简式是
故答案为:C9H10O3;
(4)B为 ,B的同分异构体符合下列条件:
,B的同分异构体符合下列条件:
i)含有邻二取代苯环结构;
ii)与FeCl3溶液发生显色反应,说明含有酚羟基,
取代基为-OH、-CH2CH2COOH;
取代基为-OH、-CH(CH3)COOH;
取代基为-OH、-COOCH2CH3;
取代基为-OH、-CH2COOCH3;
取代基为-OH、-OOCCH2CH3;
取代基为-OH、-CH2OOCCH3;
取代基为-OH、-CH2CH2OOCH;
取代基为-OH、-CH(CH3)OOCH,
所以一共有8种;其中一种结构简式为 ,
,
故答案为:8; ;
;
(5)G是乙烯,乙烯能发生加聚反应生成聚乙烯,反应方程式为nCH2=CH2$\stackrel{催化剂}{→}$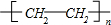 ,
,
故答案为:nCH2=CH2$\stackrel{催化剂}{→}$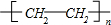 ;
;
(6)乙烯与溴发生加成反应生成1,2-二溴乙烷,1-2二溴乙烷在氢氧化钠水溶液、加热条件下发生水解反应生成乙二醇,其合成路线为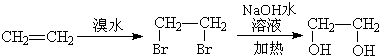 ,
,
故答案为: .
.
点评 本题考查有机物推断和合成,为高频考点,侧重考查学生分析推断及知识综合运用能力,明确官能团及其性质关系、物质之间的转化再结合题给信息进行推断,难点是有机合成类型设计及同分异构体种类判断,要考虑官能团异构,题目难度中等.


科目:高中化学 来源: 题型:选择题
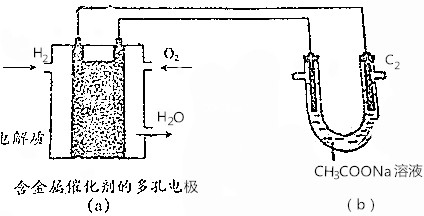
| A. | 若(a)池消耗2.24LH2,则(b)池(C1)极产生0.2mol CO2 | |
| B. | (a)池燃料电池中正极反应式为O2+4e-+4H+═2H2O | |
| C. | 将(b)池电解后的溶液加热蒸干,得到NaOH固体 | |
| D. | (b)池右侧石墨电极(C2)为电解池阴极 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 操作步骤 | 现象 |
| 步骤1:向2mL 0.005mol•L-1 AgNO3溶液中加入2mL 0.005mol•L-1 KSCN溶液,静置 | 出现白色沉淀 |
| 步骤2:取1mL上层清液于试管中,滴加1滴2mol•L-1 Fe(NO3)3溶液 | 溶液变红色 |
| 步骤3:向步骤2的溶液中,继续加入5滴3mol•L-1 AgNO3溶液 | 现象a出现白色沉淀,溶液红色变浅 |
| 步骤4:向步骤1余下的浊液中加入5滴3mol•L-1 KI溶液 | 出现黄色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,5.6 L CO2与足量Na2O2反应转移的电子数为0.5 NA | |
| B. | 78 g苯含有碳碳双键的数目为3 NA | |
| C. | 常温下,4.4gCO2和N2O混合物中所含有的原子数为0.3 NA | |
| D. | 1 L 1 mol•L-1的CuSO4溶液中含NA个Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入水时,平衡向逆反应方向移动 | |
| B. | 加入少量NaOH固体,平衡向正反应方向移动 | |
| C. | 加入少量0.1 mol•L-1 HCl溶液,平衡向逆反应方向移动,溶液中c(H+)减小 | |
| D. | 加入少量CH3COONa固体,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4 | B. | C2H4 | C. | C2H6 | D. | C2H6O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用鼻子对着盛有氯气的瓶口,就可以嗅到氯气的气味 | |
| B. | 用排水集气法便可以收集到氯气 | |
| C. | 氯气有漂白性 | |
| D. | 自来水常用氯气来杀菌、消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com