
【题目】I.由三种元素组成的化合物 A,按如下流程进行实验。气体 B 为纯净物,溶液D焰色反应为黄色。
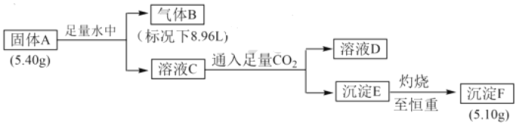
请回答:
(1)组成A的三种元素是____,A 的化学式是_____。
(2)固体A与H2O反应的化学方程式是______。
(3)化合物甲为A中的其中两种元素组成的离子化合物。甲在无水条件下可作为某些钢铁制品的脱锈剂(铁锈的成分表示为Fe2O3),脱锈过程发生反应的化学方程式_____。
II.二氧化氯(ClO2)是一种黄绿色气体,易溶于水,在混合气体中的体积分数大于10%就可能发生爆炸,在工业上常用作水处理剂、漂白剂。某小组按照以下实验装置制备ClO2并验证其某些性质。请回答下列问题:
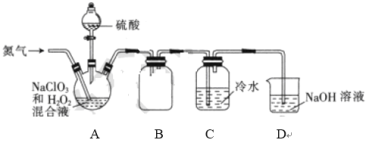
(1)通入氮气的主要作用有2个,分别是____;
(2) A中的硫酸有时也可以用浓盐酸代替, 实验过程中同时还大量生成另一种有色气体单质, 写出化学方程式:_____。
【答案】Na、Al、H NaAlH4 NaAIH4+2H2O=NaAlO2+4H2↑ 3NaH+Fe2O3=2Fe +3NaOH 一是可以起到搅拌作用,二是氮气保护, 稀释ClO2的浓度,防止爆炸 2NaClO3+4HC1=2NaCl+Cl2↑+2ClO2↑+2H2O
【解析】
Ⅰ.根据题干信息可知,气体B为纯净物,溶液D焰色反应为黄色,说明溶液D中含有Na元素,则A中含有Na元素,结合物质转化关系分析,A与水反应生成B和C,C与足量的CO2可生成溶液D和沉淀E,则A为NaAlH4,A与H2O发生反应NaAIH4+2H2O=NaAlO2+4H2↑,则B为H2,C为NaAlO2溶液,D为Na2CO3溶液,E为Al(OH)3沉淀,F为Al2O3,5.4g NaAlH4物质的量为0.1mol,5.1g Al2O3物质的量为0.05mol,所以转化过程中铝元素物质的量守恒,符合题意;据此分析解答问题;
Ⅱ.该实验为制备ClO2并验证其某些性质的实验,A为NaClO3和H2O2在酸性条件下制备ClO2的装置,B为防倒吸装置,C为验证ClO2是否溶于水,D为尾气处理装置,据此分析解答。
Ⅰ.(1)根据上述分析可知,A的化学式为NaAlH4,组成A的三种元素是Na、Al、H;
(2)固体A与H2O反应生成H2和NaAlO2,反应的化学方程式为NaAlH4+2H2O=NaAlO2+4H2↑;
(3)化合物甲为A中的其中两种元素组成的离子化合物。甲在无水条件下可作为某些钢铁制品的脱锈剂(铁锈的成分表示为Fe2O3),则甲为NaH,脱锈过程中发生反应的化学方程式为3NaH+Fe2O3=2Fe +3NaOH;
Ⅱ.(1)由于ClO2与空气混合时,在混合气体中的体积分数大于10%就可能发生爆炸,通入氮气既可以起到搅拌作用,又可以作保护气,稀释ClO2的浓度,防止爆炸;
(2)A中的硫酸有时也可以用浓盐酸代替,实验过程中同时还大量生成另一种黄绿色气体Cl2,发生的化学方程式为2NaClO3+4HC1=2NaCl+Cl2↑+2ClO2↑+2H2O。


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
【题目】在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:C(s)+2NO(g)![]() CO2(g)+N2(g),平衡时c(NO)与温度T的关系如图所示,则下列说法正确的是( )
CO2(g)+N2(g),平衡时c(NO)与温度T的关系如图所示,则下列说法正确的是( )
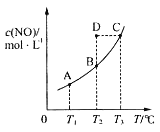
A.该反应的ΔH>0
B.若该反应在T1、T2℃时的平衡常数分别为K1、K2,则K1<K2
C.在T2℃时,若反应体系处于状态D,则此时v正>v逆
D.若状态B、C、D的压强分别为p(B)、p(C)、p(D),则p(C)=p(D)>p(B)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是用KClO3与浓盐酸反应制取氯气的简易装置。下列说法正确的是
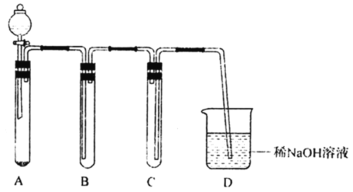
A.A中固体也可以用高锰酸钾、重铬酸钾、二氧化锰等代替
B.装置A发生反应的方程式为KClO3+6HCl(浓)=3Cl2↑+KCl+3H2O
C.待没有气泡产生后,向A中加入足量AgNO3,根据沉淀质量可求出剩余盐酸的量
D.装置B盛放的是饱和食盐水,目的为除去HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C![]() 2AlN+3CO合成。下列叙述正确的是( )
2AlN+3CO合成。下列叙述正确的是( )
A. 上述反应中,N2是还原剂,Al2O3是氧化剂
B. 上述反应中,每生成1molAlN需转移3mol电子
C. AlN中氮元素的化合价为+3
D. CO是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.4g NaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
A. B.
B.
C. D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用质量分数为36.5%的浓盐酸(密度为1.16g/cm3)配制成1mol/L的稀盐酸。现实验室仅需要这种盐酸220mL。试回答下列问题:
(1)配制稀盐酸时,应选用的容量瓶规格是_____________(填序号)。
A.25mLB.50mLC.100mLD.250mL
(2)经计算需要______mL浓盐酸,在量取时宜选用下列量筒中的_____________(填序号)。
A.5mLB.10mLC.25mLD.50mL
(3)在量取浓盐酸后,进行了下列操作:
①等稀释的盐酸其温度与室温一致后,沿玻璃棒注入容量瓶中。
②往容量瓶中小心加蒸馏水至液面接近环形标线2~3cm处,改用胶头滴管加蒸馏水,使溶液的凹面底部与瓶颈的环形标线相切。
③在盛盐酸的烧杯中注入蒸馏水,并用玻璃棒搅动,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的顺序是_____________
A.①②③④B.③④①②C.④①②③D.③①④②
(4)在上述配制过程中,用刚刚洗涤洁净的量筒来量取浓盐酸,其配制的稀盐酸浓度是_____________(填“偏高”、“偏低”、“无影响”)。若未用蒸馏水洗涤烧杯内壁或未将洗涤液注入容量瓶,则配制的稀盐酸浓度是_____________(填“偏高”、“偏低”、“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾是中学常用的试剂。工业上用软锰矿制备高锰酸钾流程。

(1)上述流程中可以循环使用的物质有________、________(写化学式)。
(2)KMnO4稀溶液是一种常用的消毒剂。其消毒原理与下列物质相同的是________(填代号)。
a.84消毒液(NaClO溶液) b.75%酒精c.苯酚
(3)理论上(若不考虑物质循环与制备过程中的损失)1molMnO2可制得________molKMnO4。
(4)操作Ⅰ的名称是________;操作Ⅱ根据KMnO4和K2CO3两物质在________(填性质)上的差异,采用________(填操作步骤)、趁热过滤得到KMnO4粗晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
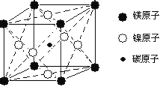
【题目】最近发现,只含镁、镍和碳三种元素的晶体竟然也具有超导性。鉴于这三种元素都是常见元素,从而引起广泛关注。
(1)该新型超导晶体的一个晶胞如图所示,则该晶体的化学式是__________。镍在元素周期表中的位置是______,Ni2+的价电子有_________种不同运动状态。
(2)500-600℃时,BeCl2以双聚分子存在的BeCl2的结构式为________________________。
(3)橙红色晶体羰基钴的熔点为52℃,分子式为Co2(CO)8,是一种重要的无机金属配合物,可溶于多数有机溶剂。该晶体属于______晶体,配体是______该配合物中存在的作用力类型有___________(填标号)。
A.金属键 B.离子键 C.共价键 D.配位键 E.氢键 F.范德华力
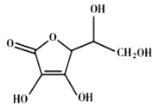
(4)抗坏血酸的分子结构如图所示,分子中碳原子的轨道杂化类型为_______;推测抗坏血酸在水中的溶解性:________(填“难溶于水”或“易溶于水”)。
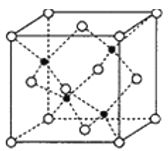
(5)副族元素Zn和元素Se形成的某化合物属于立方晶系,其晶胞结构如图所示,其中为( ![]() 为Se,
为Se,![]() 为Zn),Zn的配位数为______,该晶体的密度为
为Zn),Zn的配位数为______,该晶体的密度为![]() g/cm3,则Zn—Se键的键长为______nm。
g/cm3,则Zn—Se键的键长为______nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物c的制备原理如下:
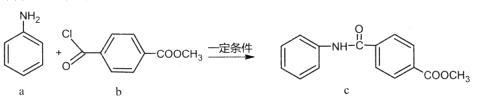
下列说法正确的是
A.该反应为加成反应B.化合物a中所有原子一定共平面
C.化合物C的一氯代物种类为5种D.化合物b、c均能与NaOH溶液反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com