
【题目】下图是用KClO3与浓盐酸反应制取氯气的简易装置。下列说法正确的是
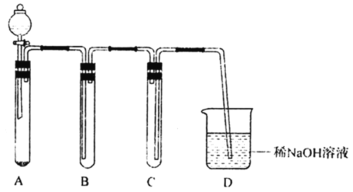
A.A中固体也可以用高锰酸钾、重铬酸钾、二氧化锰等代替
B.装置A发生反应的方程式为KClO3+6HCl(浓)=3Cl2↑+KCl+3H2O
C.待没有气泡产生后,向A中加入足量AgNO3,根据沉淀质量可求出剩余盐酸的量
D.装置B盛放的是饱和食盐水,目的为除去HCl
【答案】B
【解析】
A. 浓盐酸与二氧化锰在常温下不反应;
B. 用KClO3与浓盐酸反应,生成氯化钾、氯气和水;
C. 反应得到的产物为KCl,项其中加入足量的AgNO3,生成AgCl,如盐酸过量,与AgNO3反应也生成沉淀;
D. B装置用于收集氯气。
A. 用浓盐酸和高锰酸钾、重铬酸钾均能发生反应是被HCl,但浓盐酸与二氧化锰在常温下不反应,因此不能使用该装置,A项错误;
B. 用KClO3与浓盐酸反应,生成氯化钾、氯气和水,反应方程式为:KClO3+6HCl(浓)=3Cl2↑+KCl+3H2O,B项正确;
C. 反应得到的产物为KCl,项其中加入足量的AgNO3,生成AgCl,如盐酸过量,与AgNO3反应也生成沉淀,因此不能利用沉淀质量可求出剩余盐酸的量,C项错误;
D. B装置用于收集氯气,D项错误;
答案选B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】丙烯(C3H6)是石油化工行业重要的有机原料之一,主要用于生产聚丙烯、二氯乙烯、异丙烯等产品。
(1)丙烷脱氢制备丙烯。由图可得C3H8(g)![]() C3H6(g)+H2(g) ΔH=___kJ/mol。
C3H6(g)+H2(g) ΔH=___kJ/mol。

①为了同时提高反应速率和反应物的平衡转化率,可采取的措施是___。
②目前在丙烷脱氢制丙烯时常加入适量的O2,让其同时发生下列反应:
2C3H8(g)+O2(g)![]() 2C3H6(g)+2H2O(g) ΔH=-235kJ/mol,通入O2的目的是___。
2C3H6(g)+2H2O(g) ΔH=-235kJ/mol,通入O2的目的是___。
(2)以C4H8和C2H4为原料发生烯烃歧化反应C4H8+C2H4![]() 2C3H6(g) ΔH>0。
2C3H6(g) ΔH>0。
①某温度下,上述反应中,正反应速率为v正=k正c(C4H8)c(C2H4)、逆反应速率为v逆=k逆c2(C3H6),其中k正、k逆为速率常数,该反应使用WO3/SiO2为催化剂,下列说法中正确的是___。
A.催化剂参与了歧化反应,但不改变反应历程
B.催化剂使k正和k逆增大相同的倍数
C.催化剂降低了烯烃歧化反应的活化能,增大了活化分子百分数
D.速率常数的大小与反应历程无关系
②已知t1min时达到平衡状态,测得此时容器中n(C4H8)=amol,n(C2H4)=2amol,n(C3H6)=bmol且平衡时C3H6的体积分数为25%。再往容器内通入等物质的量的C4H8和C2H4,在新平衡中C3H6的体积分数___25%。(填“>”、“<”、“=”)
(3)工业上可用丙烯加成法制备1,2—二氯丙烷(CH2ClCHClCH3),主要副产物为3—氯乙烯(CH2=CHCH2Cl),反应原理为
Ⅰ.CH2=CHCH3(g)+Cl2(g)![]() CH2ClCHClCH3(g)
CH2ClCHClCH3(g)
Ⅱ.CH2=CHCH3(g)+Cl2(g)![]() CH2=CHCH2Cl(g)+HCl(g)
CH2=CHCH2Cl(g)+HCl(g)
一定温度下,向恒容密闭容器中充入等物质的量的CH2=CHCH3(g)和Cl2(g)。在催化剂作用下发生反应I、Ⅱ,容器内气体的压强随时间的变化如下表所示。
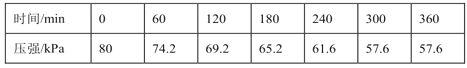
①用单位时间内气体分压的变化来表示反应速率,即v=![]() ,则前120min内平均反应速率v(CH2ClCHClCH3)=___kPamin-1。
,则前120min内平均反应速率v(CH2ClCHClCH3)=___kPamin-1。
②该温度下,若平衡时HCl的体积分数为12.5%,反应Ⅰ的平衡常数Kp=__kPa-1。(Kp为以分压表示的平衡常数,保留小数点后2位。)
查看答案和解析>>
科目:高中化学 来源: 题型:
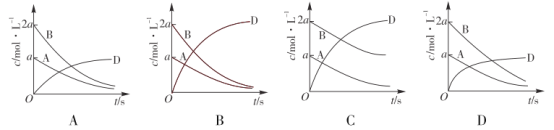
【题目】(1)①已知反应A(g)+B(g)![]() 2D(g),若在起始时c(A)=a mol L-1, c(B)=2amol L-1,则该反应中各物质浓度随时间变化的曲线是_______(选填字母序号)。
2D(g),若在起始时c(A)=a mol L-1, c(B)=2amol L-1,则该反应中各物质浓度随时间变化的曲线是_______(选填字母序号)。
②在298K时,反应A(g)![]() 2B(g)的 KP=0.1132kPa,当分压为 p(A)=p(B)=1kPa时,反应速率υ正______υ逆(填 “ <” “ =” 或 “ >” )。
2B(g)的 KP=0.1132kPa,当分压为 p(A)=p(B)=1kPa时,反应速率υ正______υ逆(填 “ <” “ =” 或 “ >” )。
③温度为 T时,某理想气体反应 A(g)+B(g)![]() C(g)+M(g),其平衡常数 K为0.25,若以 A∶B =1∶1发生反应,则 A的理论转化率为_____%(结果保留3位有效数字)。
C(g)+M(g),其平衡常数 K为0.25,若以 A∶B =1∶1发生反应,则 A的理论转化率为_____%(结果保留3位有效数字)。
(2)富勒烯 C60和 C180可近似看作“ 完美的” 球体,富勒烯的生成时间很快,典型的是毫秒级,在所有的合成技术中得到的 C60的量比 C180的量大得多。已知两个转化反应:反应物![]() 3C60 ,反应物
3C60 ,反应物![]() C180,则势能(活化能)与反应进程的关系正确的是______(选填字母序号)。
C180,则势能(活化能)与反应进程的关系正确的是______(选填字母序号)。

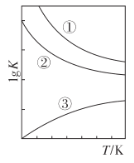
(3)甲醇脱氢和甲醇氧化都可以制取甲醛,但是O2氧化法不可避免地会深度氧化成CO。脱氢法和氧化法涉及的三个化学反应的 lgK随温度 T的变化曲线如图所示。写出图中曲线①的化学反应方程式________;曲线③的化学反应方程式为________;曲线②对应的化学反应是____(填“ 放热” 或“ 吸热” )反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知AG=lg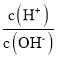 ,电离度a=
,电离度a=![]() ×l00%。常温下,向l0mL0.lmolL-1HX溶液中滴加0.lmolL-1NaOH溶液,混合溶液中AG与滴加NaOH溶液体积的关系如图所示。下列说法错误的是
×l00%。常温下,向l0mL0.lmolL-1HX溶液中滴加0.lmolL-1NaOH溶液,混合溶液中AG与滴加NaOH溶液体积的关系如图所示。下列说法错误的是
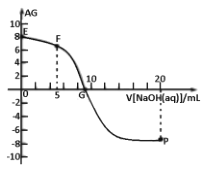
A.点P前随着NaOH溶液的加入,![]() 增大B.G点溶液中c(Na+)=c(X-)>c(H+)=c(OH-)
增大B.G点溶液中c(Na+)=c(X-)>c(H+)=c(OH-)
C.V=10时,溶液中c(OH-)>c(HX)D.常温下,HX的电离度约为0.1%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对废弃物的再利用,不仅能够减少污染,还能有效的节约资源,实现“变废为宝”。为实现某合金废料的再利用,设计流程如下:
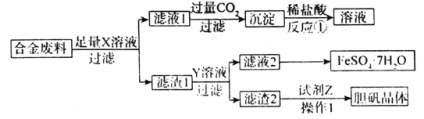
下列叙述错误的是
A.从合金废料回收的金属元素有Al、Fe、Cu
B.X可能是NaOH或H2SO4
C.操作1包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥
D.滤渣1一定含有Fe和Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以冶铜工厂预处理过的污泥渣(主要成分为 CuO 和 Cu)为原料制备 CuSO45H2O 晶体的流程如下 :
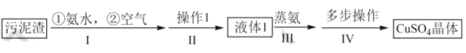
已知:①CuO在氨水作用下可以生成 Cu(NH3)4(OH)2
②CuSO45 H2O 加热到 4 5℃时开始失水。
请回答:
(1)步骤 l 中,空气的主要作用是____。
(2)下列关于步骤II说法不正确的是____。
A.操作 1 可选择倾析法过滤, 玻璃棒的作用是: 先搅拌, 再引流
B.操作 1 应趁热过滤, 要防止液体 1 中的溶质因冷却而析出
C.操作 1 为抽滤,在加入需抽滤的物质时,用玻璃棒引流液体, 玻璃棒底端需紧贴在滤纸上
D.抽滤时,布氏漏斗的底部斜口面需正对抽滤瓶的抽气口处, 是为了提高抽滤的速率
(3)液体 1 通过步骤 III 与步骤IV可得到CuSO45 H2O 晶体 。
①蒸氨过程的生成物均是由两种元素组成的化合物, 则除氨外其余产物的化学式为_____。
②步骤IV中包含多步操作, 将下列步骤按正确的步骤排序(必要时步骤可重复选)。_____→得到固体物质→ ____ →将液体放于蒸发皿中加热→ ____→_____→_____→_____ →得到晶体
a.过滤 b.用玻璃棒不断搅拌溶液 c.用足量稀硫酸溶解固体 d.停止加热 e.至溶液表面析出晶膜
(4)步骤1中分别选用氨水、氨水-碳酸铵混合溶液氨浸时, 铜元素回收率随温度变化如图所示。
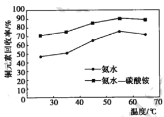
①浸取液为氨水时,反应温度控制为 55℃,温度过高铜元素回收率降低的原因是_______。
②浸取液为氨水一碳酸铵混合溶液时,铜元素回收率受温度影响较小的原因可能是______。
(5)为了提高 CuSO4晶体的产率, 实验室还采用以下方法: 将CuSO4 溶液转移至蒸馏烧瓶中, 加入适量冰醋酸, 通过下图所示的装置获取晶体。
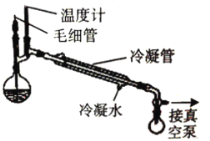
①加入适量乙酸的目的是:_____。
②图中接真空泵的作用是:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列叙述正确的是
A.在标况下,11.2LNO与11.2LO2混合后所含分子数为0.75NA
B.铝跟氢氧化钠溶液反应生成1mol氢气时,转移的电子数为NA
C.0.1molNa2O2晶体中含有0.4NA个离子
D.常温常压下,16gO3所含的电子数为8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.由三种元素组成的化合物 A,按如下流程进行实验。气体 B 为纯净物,溶液D焰色反应为黄色。
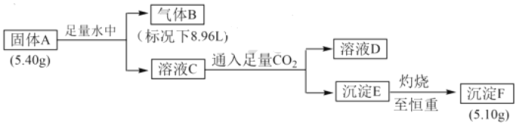
请回答:
(1)组成A的三种元素是____,A 的化学式是_____。
(2)固体A与H2O反应的化学方程式是______。
(3)化合物甲为A中的其中两种元素组成的离子化合物。甲在无水条件下可作为某些钢铁制品的脱锈剂(铁锈的成分表示为Fe2O3),脱锈过程发生反应的化学方程式_____。
II.二氧化氯(ClO2)是一种黄绿色气体,易溶于水,在混合气体中的体积分数大于10%就可能发生爆炸,在工业上常用作水处理剂、漂白剂。某小组按照以下实验装置制备ClO2并验证其某些性质。请回答下列问题:
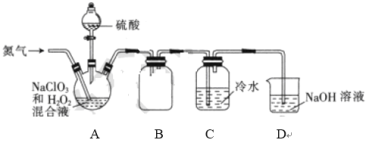
(1)通入氮气的主要作用有2个,分别是____;
(2) A中的硫酸有时也可以用浓盐酸代替, 实验过程中同时还大量生成另一种有色气体单质, 写出化学方程式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.二氧化锰和浓盐酸反应:MnO2+4HCl(浓)![]() Mn2++2Cl-+Cl2↑+2H2O
Mn2++2Cl-+Cl2↑+2H2O
B.氯气与氢氧化钠溶液反应Cl2+2OH-=ClO-+Cl-+H2O
C.铜和稀硝酸反应:3Cu+8H++2NO3-=3Cu2++2NO2↑+4H2O
D.氯化铝和氨水反应:Al3++3OH-=Al(OH)3↓
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com