
����Ŀ����A��B��C��D��E���ֶ�����Ԫ�أ���֪���ڵ�A��B��C��D����Ԫ��ԭ�Ӻ����56�����ӣ������ڱ��е�λ����ͼ��ʾ��E�ĵ��ʿ����ᷴӦ�� 1mol E���������������ã��ڱ�״�����ܲ���33.6LH2��E����������A�������Ӻ�����Ӳ�ṹ��ȫ��ͬ���ش��������⣺

��1��AԪ�ص�����Ϊ____________��D���ӵĽṹʾ��ͼΪ_____________��
��2��C�����ڱ��е�λ��Ϊ______________________��
��3��Ԫ��C��Ԫ��D��ȣ��ǽ����Խ�ǿ����__________����Ԫ�ط��ű�ʾ�������б�������֤����һ��ʵ����________��������ĸ��ţ�
a��������C�ĵ��ʺ�D�ĵ���״̬��ͬ
b��D����̬�⻯���C����̬�⻯���ȶ�
c��һ��������C��D�ĵ��ʶ���������������Һ��Ӧ
d��D������������ˮ��������Ա�C������������ˮ���������ǿ
e��D�ĵ����ܺ�C��������Һ��Ӧ����C�ĵ���
��4��Ԫ��A��һ���⻯�ﺬ�зǼ��Լ���A�������⻯��ĵ���ʽ��____________��
��5��A��C��D��EԪ���γɵļ����Ӱ뾶�Ĵ�С˳����________���������ӷ��ű�ʾ��
��6��E������������Ӧ��ˮ���������������Һ��Ӧ�Ļ�ѧ����ʽ��________________��
���𰸡��� 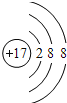 �������ڢ�A�� Cl bde
�������ڢ�A�� Cl bde ![]() S2- > Cl- > O2- > Al3+ Al(OH)3 + NaOH = NaAlO2 + 2H2O
S2- > Cl- > O2- > Al3+ Al(OH)3 + NaOH = NaAlO2 + 2H2O
��������
A��B��C��D��E���ֶ�����Ԫ�أ�����Ԫ�����ڱ�֪��������Ԫ�ش��ڵڶ��������ڣ���C��ԭ��������X����A��B��D��ԭ�������ֱ���(X-8)��(X-1)��(X+1)�����ڵ�A��B��C��D����Ԫ��ԭ�Ӻ����56�����ӣ���(X-8)+(X-1)+X+(X+1)=56����X=16������C��SԪ�أ�A��OԪ�أ�B��PԪ�أ�D��ClԪ�أ�E�ĵ��ʿ����ᷴӦ��1molE���������������ã��ڱ�״�����ܲ���33.6LH2����һ��Eԭ��ʧȥ3���������������ӣ�E����������A�������Ӻ�����Ӳ�ṹ��ȫ��ͬ����E��AlԪ�أ��Դ˽����⡣
A��B��C��D��E���ֶ�����Ԫ�أ�����Ԫ�����ڱ�֪��������Ԫ�ش��ڵڶ��������ڣ���C��ԭ��������X����A��B��D��ԭ�������ֱ���(X-8)��(X-1)��(X+1)�����ڵ�A��B��C��D����Ԫ��ԭ�Ӻ����56�����ӣ���(X-8)+(X-1)+X+(X+1)=56����X=16������C��SԪ�أ�A��OԪ�أ�B��PԪ�أ�D��ClԪ�أ�E�ĵ��ʿ����ᷴӦ��1molE���������������ã��ڱ�״�����ܲ���33.6LH2����һ��Eԭ��ʧȥ3���������������ӣ�E����������A�������Ӻ�����Ӳ�ṹ��ȫ��ͬ����E��AlԪ�أ�
(1)�ɷ�����֪AΪO��Ԫ�ص�����Ϊ����DΪClԪ�أ�Cl-���ӵĽṹʾ��ͼΪ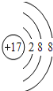 ��
��
(2)CΪ��Ԫ�أ��˵����Ϊ16��ԭ�ӽṹʾ��ͼΪ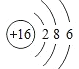 �����������ڱ��е�λ��Ϊ�������ڢ�A�壻
�����������ڱ��е�λ��Ϊ�������ڢ�A�壻
(3)ͬ��������Ԫ�غ˵������Ԫ�صķǽ�����ǿ����ClԪ�طǽ����Ա�SԪ��ǿ��
a������״̬�����������ʣ����ܱȽ�Ԫ�طǽ����ԣ���a����
b���⻯���ȶ�����Ԫ�طǽ�����һ�£��Ȼ���������ȶ���˵���ȵķǽ����Ը�ǿ����b��ȷ��
c��һ��������Cl2��S����������������Һ��Ӧ��֤��S��Cl2�����������ԣ����л�ԭ�ԣ��������ж������ȵķǽ�����ǿ������c����
d��Ԫ�صķǽ�����Խǿ�����������ˮ���������Խǿ����Cl������������ˮ��������Ա�S������������ˮ���������ǿ��˵��Cl�ķǽ����Ա�Sǿ����d��ȷ��
e��Cl2�ܺ�Na2S��Һ��Ӧ����S���ʣ�˵��Cl�ķǽ����Ա�Sǿ����e��ȷ��
�ʴ�Ϊbde��
(4)Ԫ��AΪ������HԪ����ɵĻ�����H2O2�к��зǼ��Լ���H2O2�ĵ���ʽ��![]() ��
��
(5)O2-��Al3+��S2-��Cl-�����ӽṹ��ͬ���˵���������Ӱ뾶С����S2-��Cl-�����ӽṹ��O2-��Al3+��һ�����Ӳ㣬�����������ӵ����Ӱ뾶�ɴ�С��˳��ΪS2-��Cl-��O2- �� Al3+��
(6)Al(OH)3������������Һ��Ӧ����ƫ�����ƺ�ˮ����Ӧ�Ļ�ѧ����ʽ��Al(OH)3 + NaOH = NaAlO2 + 2H2O��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ӹ����������仯�������������������е����÷����˾�仯��
��1���Ŵ��й��Ĵ���֮һ��ָ����������Ȼ��ʯ�Ƴɵģ�����Ҫ�ɷ���______������ĸ��ţ���
a��Fe b��FeO c��Fe3O4 d��Fe2O3
��2������������Ҫ��ѧ�ɷ�Ϊ��SiO2Լ45%��Fe2O3Լ40%��Al2O3Լ10%��MgOԼ5%���ø÷�����ȡҩ�ø��ϡ������������Ĺ����������£����ֲ����������ԣ���
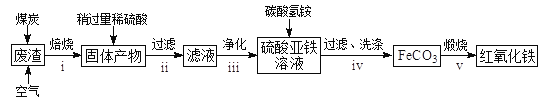
�ش��������⣺
���ڲ���i�в������ж����������__________________��
���ڲ���iii�����У�Ҫ��ȥ������֮һΪAl3����������ʱKsp[Al(OH)3]=1.0��10��32����ʱ������ʹAl3+ǡ�ó�����ȫ����Һ��c(Al3+)=1��10-5mol/L������Һ��pHΪ____________��
�۲���iv�У�����FeCO3�����ӷ���ʽ��_________________��
��3���Ȼ�����Һ��Ϊ��ѧ�Լ��еġ������֡������Ȼ�ͭ���Ȼ����Ļ����Һ�м�����������ͭ��ĩ�����������д���ó����Ļ�ѧʽ______________����һ���̵��ܷ�Ӧ�����ӷ���ʽ______��
��4�����϶��������ɫȾ����³ʿ���ĺϳɷ������£�

���ֽⷴӦii�����ӷ���ʽ��________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��l����������ϩ�Ļ��������ȫȼ�գ���Ҫ����2.4���(��ͬ״��)����ԭ��������м�����������Ϊ___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Bilirubin��һ�������������·����ֽⷴӦ����Ӧ��Ũ���淴Ӧʱ��仯��ͼ��ʾ�����㷴Ӧ48minƽ����Ӧ���ʺ��ƲⷴӦ16minʱ��Ӧ���Ũ�ȣ����Ӧ��( )
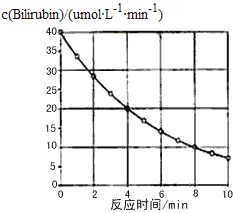
A. 2.5��mol/(L��min)�� 2.0��molB. 2.5��mol/(L��min)�� 2.5��mol
C. 3.0��mol/(L��min)�� 3.0��molD. 5.0��mol/(L��min)�� 3.0��mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��U�ι���ʢ��150mL����Һ����Ҫ��ش��������⣺
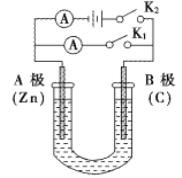
(1)��K2���պ�K1������ʢ��ҺΪϡ���ᣬ��B��Ϊ___��(��缫����)��A���ĵ缫��ӦʽΪ��______��
(2)��K1���պ�K2������ʢ��ҺΪNaCl��Һ��һ��ʱ���U�ι�����Һ��pH___________(���������䡱��С��)��A���ĵ缫��ӦʽΪ��____________________________����ҪʹU�ι�����Һ�ָ�����ʼ״̬��Ӧ��U�ι��ڵ���Һ����(��ͨ��)___________�����ѧʽ��
(3)���Ҫ�������϶���ͭ����K1���պ�K2�����Һѡ��CuSO4��Һ����A�缫�IJ���Ӧ������___(����顱��ͭ��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��ӦA+B=C+D�������仯��ͼ��ʾ(E1��E2��Ϊ��ֵ)������˵����ȷ����

A. �ƻ���Ӧ���еĻ�ѧ�������յ�����С���γ��������л�ѧ�����ų�������
B. �÷�Ӧ���յ�����Ϊ(E1-E2)
C. A��B��������һ������C��D��������
D. �÷�Ӧֻ���ڼ��������²��ܽ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�����ȼ�ϵ�ص�˵����ȷ����( )
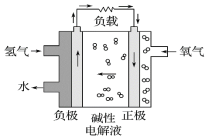
A. ��װ���ɵ���ת��Ϊ��ѧ��
B. �����ĵ缫��ӦʽΪO2+2H2O+4e-=4OH-
C. ����22.4L O2ת��4mol����
D. �ŵ�����м��Ե��Һ��OH-�����ʵ���Ũ�Ȳ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���̷�(FeSO4��7H2O)�ڹ�ҵ�Ͽ������������Ρ��������켰����ȡ���������������м(����������������������)Ϊԭ�����������̷���һ�ַ�����

25�� | pHֵ |
����H2S��Һ | 3.9 |
SnS������ȫ | 1.6 |
FeS��ʼ���� | 3.0 |
FeS��ʼ���� | 5.5 |
��1�������Ƶõ��̷��������Ƿ���Fe3�������ѡ�õ��Լ�Ϊ________��
A��KSCN��Һ B��NaOH��Һ C��KMnO4��Һ D��������Һ
��2���������У�ͨ�����������͵�Ŀ����______________________________________������Һ���������ữ��pH��2��Ŀ����__________________________________��
��3����������˳������Ϊ_________________����ȴ�ᾧ��____________________��
��4���������õ����̷�������������ˮϴ�ӣ���Ŀ���ǣ��ٳ�ȥ������渽�ŵ���������ʣ���_________________________________________________________��
��5���ⶨ�̷���Ʒ��Fe2�������ķ����ǣ�a.��ȡ2.850 g�̷���Ʒ���ܽ⣬��250 mL����ƿ�ж��ݣ�b.��ȡ25.00 mL������Һ����ƿ�У�c.�������ữ��0.010 00 mol��L��1 KMnO4��Һ�ζ����յ㣬����KMnO4��Һ�����ƽ��ֵΪ20.00 mL��
�ٵζ�ʱʢ��KMnO4��Һ������Ϊ________________________(����������)��
�ڼ���������Ʒ��FeSO4��7H2O����������Ϊ____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݻ�Ϊ1.00 L�������У�ͨ��һ������N2O4��������ӦN2O4(g)![]() 2NO2(g)�����¶����ߣ�����������ɫ���
2NO2(g)�����¶����ߣ�����������ɫ���

(1)��ӦΪ_______ (��������������������)��100 ��ʱ����ϵ�и�����Ũ����ʱ��仯��ͼ��ʾ����0��60 s����Ӧ����v(N2O4)Ϊ__________mol��L��1��s��1����Ӧ��ƽ�ⳣ��K1Ϊ_____________��
(2)100 ��ʱ��ƽ��ı䷴Ӧ�¶�ΪT��c(N2O4) ��0.001 0 mol��L��1��s��1��ƽ�����ʽ��ͣ���10 s�ִﵽƽ�⡣
��T________100 ��(������������������)��
���¶�Tʱ��Ӧ��ƽ�ⳣ��K2_________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com