
【题目】在容积为1.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。

(1)反应为_______ (填“吸热”或“放热”);100 ℃时,体系中各物质浓度随时间变化如图所示。在0~60 s,反应速率v(N2O4)为__________mol·L-1·s-1;反应的平衡常数K1为_____________。
(2)100 ℃时达平衡后,改变反应温度为T,c(N2O4) 以0.001 0 mol·L-1·s-1的平均速率降低,经10 s又达到平衡。
①T________100 ℃(填“大于”或“小于”),
②温度T时反应的平衡常数K2_________。
【答案】吸热 0.001mol·L-1·s-1 k1=0.36 > k2=0.65
【解析】
(1)随温度升高,混合气体的颜色变深,说明升高温度平衡正向移动,则正反应为吸热反应;根据v=![]() 计算v(N2O4),平衡常数K1=
计算v(N2O4),平衡常数K1= ;
;
(2)①改变温度后,N2O4的浓度降低,平衡向正反应方向移动,由于正反应吸热反应,升高温度平衡正向移动;
②平衡时,c(NO2)=0.120molL-1+0.0010molL-1s-1×10s×2=0.14molL-1,c(N2O4)=0.040molL-1-0.0010molL-1s-1×10s=0.030molL-1,代入平衡常数K2= 计算。
计算。
(1)随温度的升高,混合气体的颜色变深,说明升高温度平衡正向移动,则正反应为吸热反应;0~60s时段,N2O4浓度变化为:0.1mol/L-0.04mol/L=0.06mol/L,v(N2O4)=![]() =0.0010molL-1s-1;K1=
=0.0010molL-1s-1;K1= =
=![]() =0.36;
=0.36;
(2)①改变温度后,N2O4的浓度降低,平衡向正反应方向移动,由于正反应吸热,升高温度平衡正向移动,故T>100℃;
②平衡时,c(NO2)=0.120molL-1+0.0010molL-1s-1×10s×2=0.14molL-1,c(N2O4)=0.040molL-1-0.0010molL-1s-1×10s=0.030molL-1,则平衡常数K2= =
=![]() =0.65。
=0.65。


科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的单质可与酸反应, 1mol E单质与足量酸作用,在标准状况下能产生33.6LH2;E的阳离子与A的阴离子核外电子层结构完全相同,回答下列问题:

(1)A元素的名称为____________,D离子的结构示意图为_____________。
(2)C在周期表中的位置为______________________。
(3)元素C与元素D相比,非金属性较强的是__________(用元素符号表示),下列表述中能证明这一事实的是________。(填字母序号)
a.常温下C的单质和D的单质状态不同
b.D的气态氢化物比C的气态氢化物稳定
c.一定条件下C和D的单质都能与氢氧化钠溶液反应
d.D的最高价氧化物的水化物的酸性比C的最高价氧化物的水化物的酸性强
e.D的单质能和C的钠盐溶液反应生成C的单质
(4)元素A的一种氢化物含有非极性键,A的这种氢化物的电子式是____________。
(5)A、C、D、E元素形成的简单离子半径的大小顺序是________。(用离子符号表示)
(6)E的最高价氧化物对应的水化物跟氢氧化钠溶液反应的化学方程式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某仅由碳、氢、氧三种元素组成的有机化合物,经测定其相对分子质量为90。取有机物样品1.8 g,在纯氧中完全燃烧,将产物先后通过浓硫酸和碱石灰,两者分别增重1.08 g和2.64 g。试求该有机物的分子式。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含Al2(SO4)3和AlCl3的混合溶液中逐滴加入1mol/LBa(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所得沉淀的物质的量的关系如图,下列说法不正确的是
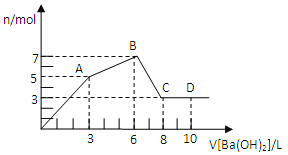
A. 原混合液中c(SO42-):c(Cl-)=1:1
B. 向D点溶液中通入C02气体,立即产生白色沉淀
C. 图中A点沉淀中含有BaSO4和Al(OH)3
D. AB段反应的离子方程式为:Al3++3OH-=Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某温度时,反应CO(g)+ H2O(g)![]() CO2(g) + H2(g)的平衡常数k =1.0,该温度下,向2L的密闭容器中充入2molCO和2mol水蒸气,充分反应达到平衡状态。
CO2(g) + H2(g)的平衡常数k =1.0,该温度下,向2L的密闭容器中充入2molCO和2mol水蒸气,充分反应达到平衡状态。
(1)求平衡时CO2的浓度_____。
(2)求CO的转化率_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示装置中,观察到电流计指针偏转,M棒变粗,N棒变细,其中P为电解质溶液。由此判断M、N、P所代表的物质可能是( )

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列各组溶解度曲线图,判断分离提纯方法。
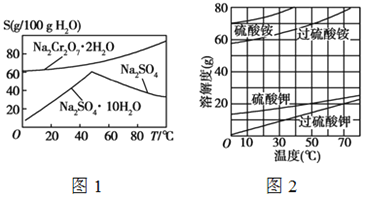
(1)根据图1中Na2SO4和Na2SO4·10H2O的溶解度曲线(g/100 g水),由Na2SO4溶液得到Na2SO4固体的操作为:将溶液升温结晶、 、用乙醇洗涤后干燥。用乙醇洗涤而不用水洗的原因是 。
(2)根据图2所示相关物质的溶解度曲线。在实验室中提纯过硫酸钾粗产品的实验具体操作依次为:将过硫酸钾粗产品溶于适量水中, ,干燥。
(3)根据图1中红矾钠(Na2Cr2O7·2H2O)和Na2SO4的溶解度曲线。从Na2Cr2O7和 Na2SO4的混合溶液中提取红矾钠的操作为:先将混合溶液蒸发浓缩,趁热过滤。趁热过滤的目的是 ;然后将滤液 ,从而析出红矾钠。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用于制造飞机的材料应具备高比强度(断裂强度/密度),还应具备密度小、质地轻的特点。以波音747为例,机身每减轻1 kg,因耗油减少,一年可获利2 000美元。你认为下列材料中可用于飞机制造业的是 ( )
A.MgAl合金B.黄铜(CuZn合金)
C.NaK合金D.生铁(FeC合金)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com