
高铁酸钾广泛应用于净水、电池工业等领域。工业上以钛白粉生产的副产品FeSO4制备高铁酸钾的生产流程如下: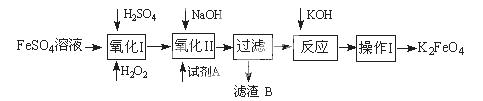
查资料得知K2FeO4的一些性质:
①在碱性环境中稳定,在中性和酸性条件下不稳定
②溶解度很大,难溶于无水乙醇等有机溶剂
③具有强氧化性,能氧化有机烃、苯胺和80%以下乙醇溶液
回答下列问题:
(1)写出“氧化I”中,生成Fe3+的离子反应方程式 。
(2)氧化II中,试剂A为 (填“H2O2”或“HNO3”或“NaClO”);过滤操作中,得到的滤渣B中除NaCl还有
(3)操作I中包括冷却结晶、过滤、洗涤干燥几个步骤。洗涤干燥的目的是脱碱脱水,进行该操作时最好用 洗涤。
(4)净水时高铁酸钾能逐渐与水反应生成絮状的Fe(OH)3,请补充并配平该反应方程式: K2FeO4 + H2O = Fe(OH)3↓ + KOH +
(5)将一定量的K2FeO4投入一定浓度的FeCl3溶液中,测得剩余K2FeO4浓度如下图所示,推测产生曲线I和曲线II差异的原因是 。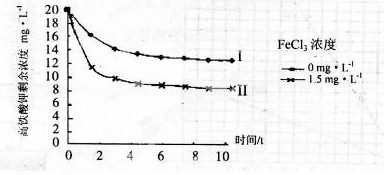
(16分)
(1)H2O2+2H++2Fe2+=2Fe3++2H2O(3分,配平错扣1分)
(2)NaClO Na2SO4(各2分,共4分)
(3)无水乙醇(3分)
(4)4 10 4 8 3O2 ↑ (产物正确1分,共3分)
(5)FeCl3溶液水解显酸性,促进K2FeO4与水反应,从而降低K2FeO4浓度(3分)
解析试题分析:(1)原料为硫酸亚铁溶液,所含亚铁离子具有还原性,硫酸是强酸,提供氢离子,不仅能抑制亚铁离子和铁离子的水解,而且能增强过氧化氢的氧化能力,使亚铁离子氧化为铁离子,根据化合价升降法、电荷守恒、原子守恒配平,则氧化I中生成铁离子的离子方程式为H2O2+2H++2Fe2+=2Fe3++2H2O;(2)由于目标产物是K2FeO4,它在碱性环境中稳定,在中性和酸性条件下不稳定,则氧化II中加入的氧化剂不能使H2O2,因为H2O2在碱性条件下的氧化性比酸性条件下弱,试剂A也不能是HNO3,因为酸性条件下Na2FeO4不稳定,试剂A只能是 NaClO,氧化II中反应为2NaOH+H2SO4=Na2SO4+2H2O、Fe2(SO4)3+3NaClO+10NaOH==2Na2FeO4+3NaCl+3Na2SO4+5H2O;根据已知信息可知,K2FeO4的溶解度很大,由此类推Na2FeO4的溶解度很大,为了从Na2FeO4、NaCl、Na2SO4、NaClO(过量)、NaOH(过量)组成的混合溶液中分离出Na2FeO4、NaOH(过量),则过滤所得滤渣的主要成分为NaCl、Na2SO4、NaClO(过量),除去它们之后所得的Na2FeO4、NaOH(过量)溶液用于制备K2FeO4;(3)Na2FeO4、NaOH(过量)溶液中加入过量KOH时的反应为:Na2FeO4+2KOH= K2FeO4+2NaOH,所得溶液经过蒸发浓缩、冷却结晶、过滤、洗涤可得K2FeO4晶体;由于K2FeO4的溶解度很大,难溶于无水乙醇等有机溶剂,且具有强氧化性,能氧化有机烃、苯胺和80%以下乙醇溶液,除去碱的同时,为了减少洗涤晶体造成K2FeO4的损失,最好选择无水乙醇洗涤K2FeO4晶体;(4)观察可得,该反应中铁元素由+6价将为+3价,钾元素、氢元素的化合价都没有变化,根据氧化还原反应的特征推断,化合价升高的元素只能是氧,氧元素由—2价升为其相邻的0价,则缺项物质为氧气,根据化合价升降法、原子守恒配平可得:4K2FeO4+10H2O==4Fe(OH)3↓ +8KOH+3O2↑;(5)根据已知信息可知,K2FeO4在碱性环境中稳定,在中性和酸性条件下不稳定,氯化铁是强酸弱碱盐,能水解,导致其溶液显弱酸性,K2FeO4在酸性条件下不稳定,酸性越强,K2FeO4越不稳定,反应速率越大,剩余K2FeO4的浓度越小。
考点:考查物质制备化学工艺流程,涉及离子方程式的书写和配平、滤渣成分的推断、氧化还原反应方程式的书写和配平、晶体的洗涤方法和试剂、提取信息并用于解释原因等。


科目:高中化学 来源: 题型:填空题
现有失去标签的CaCl2.、AgNO3、HCl和Na2CO3四瓶溶液。为了确定这四种溶液成分,将他们编号为A、B、C、D后进行化学实验。实验记录如下:
| 实验顺序 | 实验内容 | 实验现象 |
| ① | A+B | 无现象 |
| ② | B+D | 有气体放出 |
| ③ | C+B | 有沉淀生成 |
| ④ | A+D | 有沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
多原子分子氰(CN)2、硫氰(SCN)2和(OCN)2的性质与卤素单质(Cl2、Br2等)相似,故称它们为拟卤素。它们可以生成酸和盐(见下表,表中X代表F、Cl、Br或I)。
| | 卤素 | 氰 | 硫氰 | ① |
| “单质” | X2[ | (CN)2 | (SCN)2 | (OCN)2 |
| 酸 | HX | HCN | ② | HOCN |
| 盐 | KX | KCN | KSCN | KOCN |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
现有A、B、C、D、E、F六种化合物,已知它们的阳离子有K+、Ag+、Ca2+、Ba2+、 Fe2+、 Al3+,阴离子有Cl-、 OH-、CH3COO-、NO3-、SO42-、CO32-,现将它们分别配成0.1mol·L-1的溶液,进行如下实验:
①测得溶液A、C、E呈碱性,且碱性为A>E>C;
②向B溶液中滴加稀氨水,先出现沉淀,继续滴加氨水,沉淀消失;
③向D溶液中滴加Ba(NO3)2溶液,无明显现象;
④向F溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红褐色。 请根据上述实验现象,写出下列六种化合物的化学式:
A ,B________,C ,D ,E ,F 。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
Ⅰ.某溶液中仅含下表离子中的5种离子(不考虑水的电离及离子的水解),且离子的物质的量均为1mol。
| 阴离子 | SO42-、NO3-、Cl- |
| 阳离子 | Fe3+、Fe2+、NH4+、Cu2+、Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(15分)废旧碱性锌锰干电池内部的黑色物质A主要含有MnO2、NH4Cl、ZnCl2,还有少量的FeCl2和炭粉,用A制备高纯MnCO3的流程图如下。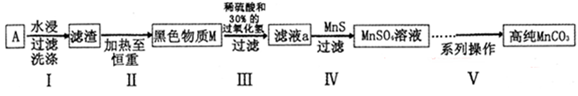
(1)碱性锌锰干电池的负极材料是 (填化学式)。
(2) 第I步操作得滤渣的成分是 ;第Ⅱ步操作的目的是 。
(3)步骤Ⅲ中制得MnSO4,该反应的化学方程式为 。
(4)第Ⅳ步操作是对滤液a进行深度除杂,除去Zn2+的离子方程式为 。
(已知:Ksp(MnS)=2.5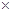 10-13,Ksp(ZnS)=1.6
10-13,Ksp(ZnS)=1.6 10-24)
10-24)
(5)已知:MnCO3难溶于水和乙醇,潮湿时易被空气氧化,l00oC时开始分解;Mn(OH)2开始沉淀时pH为7.7。
第V步系列操作可按以下步骤进行:
操作l:加入试剂X,控制pH<7.7; 操作2:过滤,用少量水洗涤2~3次;
操作3:检测滤液; 操作4:用少量无水乙醇洗涤2~3次;
操作5:低温烘干。
①试剂X是 ;
②操作3中,说明SO42-已除干净的方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
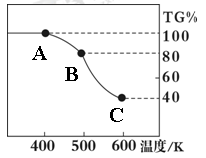
MnO2的一些性质或用途如图,下列说法正确的是 ( )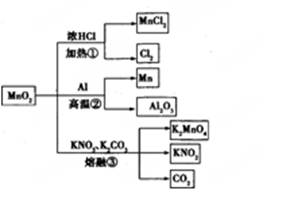
| A.①、②、③三个反应中MnO2均作氧化剂 |
| B.足量MnO2与2 L 10 mol/LHCl共热,可生成5 mol C12 |
| C.反应②若生成1 mol Al2O3,则反应过程中转移12 mol电子 |
| D.反应③中K2CO3和KNO3的化学计量数均为1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,在水溶液中发生如下反应:( )
①16H++10C-+2XO4 - = 2X2++5C2+8H2O;②2A2++B2 = 2A3++2B-;③2B-+C2 = B2+2C-。
下列说法错误的是
| A.反应C2 + 2A2+ = 2A3+ + 2C- 可以进行 |
| B.还原性由强到弱的顺序是C->A2+>B->X2+ |
| C.氧化性由强到弱的顺序是XO4->C2>B2>A3+ |
| D.反应③是置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列反应中,H2O作还原剂的是
| A.2Na2O2+2H2O =" 4NaOH" + O2↑ | B.2F2+2H2O =" 4HF" + O2↑ |
| C.3NO2 + H2O =" NO" + 2HNO3 | D.3Fe+4H2O(g)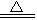 4H2+Fe3O4 4H2+Fe3O4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com