
【题目】某无色溶液W由下列离子中的若干种组成:H+、![]() 、Fe3+、Ba2+、Mg2+、
、Fe3+、Ba2+、Mg2+、![]() 、I-、OH-、
、I-、OH-、![]() 。向W中加入铝粉后有气体Y、含铝元素的离子X等生成。若不考虑水的电离,则下列说法中正确的是
。向W中加入铝粉后有气体Y、含铝元素的离子X等生成。若不考虑水的电离,则下列说法中正确的是
A.X一定是Al3+B.Y一定是H2
C.W中最多含有6种离子D.溶液中不可能含![]()
【答案】D
【解析】
无色溶液中一定不存在有色的Fe3+;向W中加入铝粉后有气体Y、含铝元素的离子X等生成,溶液可能呈酸性,也可能呈碱性,
若溶液为酸性,则一定不存在:OH-、CO32-,若阴离子含为I-,I-具有强还原性,则一定不含NO3-,此时气体Y为氢气;若阴离子含为NO3-,酸性条件下NO3-具有强氧化性,则一定不含I-,此时气体Y为NO,阳离子可以为:H+、NH4+、Ba2+、Mg2+,W中最多含有5种离子,这时生成的含铝元素的离子X为Al3+;
若溶液为碱性,则不存在Mg2+、H+、NH4+,阳离子只能为Ba2+,则一定不存在CO32-,可存在的离子为:Ba2+、I-、OH-、NO3-,W中最多含有4种离子,则这时生成的含铝元素的离子X为AlO2-;
综上所述,ABC错误,D正确;


科目:高中化学 来源: 题型:
【题目】ZrO2常用陶瓷材料,可由锆英砂(主要成分为ZrSiO4, 也可表示为ZrO2SiO2还含少量FeCO3、Fe2O3、Al2O3、SiO2等杂质)通过如下方法制取:
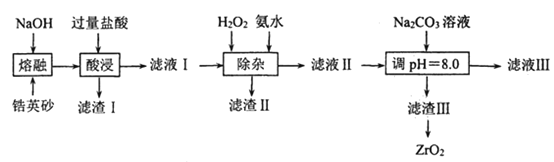
已知:①ZrSiO4能与烧碱反应生成可溶于水的Na2ZrO3,Na2ZrO3与酸反应生成ZrO2+;
②常温下,Ksp[Fe(OH)3= 1×10-38,Ksp [(Al(OH)3= 1×10-32;pH=6.2时,ZrO2+开始沉淀.
(1)“熔融”过程中 ,ZrSiO4发生反应的化学方程式为______________________;滤渣 I的化学式为________________________。
(2)“除杂”过程中,加入双氧水的目的是________________:此过程中为使滤液I中的杂质离子沉淀完全而除去(当离子浓度c≤1×10-5 molL-1时即为沉淀完全) ,室温下加氪水调节pH范围为____________________。
(3)为得到纯净的ZrO2滤渣III要用水洗,检验沉淀是否洗涤干净的方法是_______。
(4)滤渣III的成分是Zr(CO3)2 nZr(OH)4。“调 pH=8.0”时,所发生反应的离子方程式为_______________________;滤渣III制备ZrO2的方法是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施或事实不能用勒夏特列原理解释的是( )
A. 新制的氯水在光照下颜色变浅
B. H2、I2、HI平衡混合气加压后颜色变深
C. 在合成氨的反应中,降温或加压有利于氨的合成
D. Fe(SCN)3溶液中加入6mol/L NaOH溶液后颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物![]() 是一种有机光电材料中间体。实验室由芳香族化合物
是一种有机光电材料中间体。实验室由芳香族化合物![]() 制备
制备![]() 的一种合成路线如下:
的一种合成路线如下:
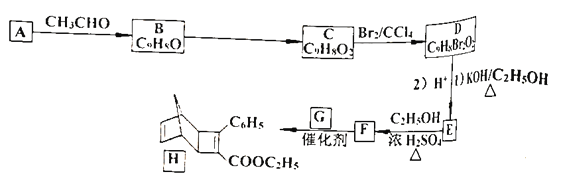
已知:①![]()
②![]() +
+![]()
![]()
![]()
回答下列问题:
(1)有机物![]() 的名称是__________。
的名称是__________。![]() 所含官能团的名称是__________。
所含官能团的名称是__________。
(2)已知②中物质“![]() ”的同系物丙烯是一种医疗卫生用布——聚丙烯无纺布的原材料,用化学符号表示丙烯的结构简式为__________。
”的同系物丙烯是一种医疗卫生用布——聚丙烯无纺布的原材料,用化学符号表示丙烯的结构简式为__________。
(3)![]() 能发生的反应类型分别是__________。
能发生的反应类型分别是__________。
a.聚合反应 b.加成反应 c.消去反应 d.取代反应
(4)![]() 的反应,若只把条件(1)改为
的反应,若只把条件(1)改为![]() ,则生成物
,则生成物![]() 的结构简式是__________。
的结构简式是__________。
(5)写出![]() 的化学方程式__________。
的化学方程式__________。
(6)![]() 为甲苯的同分异构体,
为甲苯的同分异构体,![]() 的结构简式是__________。
的结构简式是__________。
(7)参照如下合成路线,写出用![]() 和
和![]() 为原料经以上合成路线制备化合物
为原料经以上合成路线制备化合物![]() 的合成路线________(其它试剂任选)原料……
的合成路线________(其它试剂任选)原料……![]() 产物
产物
(8)芳香化合物![]() 是
是![]() 的同分异构体,
的同分异构体,![]() 能与饱和碳酸氢钠溶液反应放出
能与饱和碳酸氢钠溶液反应放出![]() ,苯环上的烃基为乙基,其核磁共振氢谱显示苯环上有4种不同化学环境的氢,峰面积比为1:1:1:1。写出一种符合要求的
,苯环上的烃基为乙基,其核磁共振氢谱显示苯环上有4种不同化学环境的氢,峰面积比为1:1:1:1。写出一种符合要求的![]() 的结构简式:__________ 。
的结构简式:__________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图a是1 mol NO2和1 mol CO恰好反应生成CO2和NO过程中的能量变化示意图;现往体积固定的密闭容器中通入等物质的量的NO2 和CO,反应中的CO和NO的浓度随时间变化的示意图如b图。根据图意回答下列问题:
a 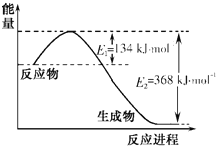 b
b
(1)写出NO2和CO反应的热化学方程式_____________________________________。
(2)从反应开始到平衡,用NO2浓度变化表示平均反应速率v(NO2)=_____________。
(3)此温度下该反应的平衡常数K=___________。
(4)830K时,在密闭容器中发生下列可逆反应:CO(g)+H2O(g)![]() CO2(g)+H2(g)△H<0。试回答下列问题:
CO2(g)+H2(g)△H<0。试回答下列问题:
①若起始时c(CO)=2mol·L-1,c(H2O)=3mol·L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K=____________。
②在相同温度下,若起始时c(CO)=1mol·L-1,c(H2O)=2mol·L-1,反应进行一段时间后,测得H2的浓度为0.5mol·L-1,则此时该反应是否达到平衡状态______(填“是”与“否”),此时v(正)____v(逆)(填“大于”“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中由于哑铃形的C22﹣存在,使晶胞沿一个方向拉长.下列关于CaC2晶体的说法中正确的是( )

A. 1 个 Ca2+周围距离最近且等距离的 C22﹣数目为 6
B. 该晶体中的阴离子与F2是等电子体
C. 6.4 g CaC2晶体中含阴离子0.1 mol
D. 与每个Ca2+距离相等且最近的Ca2+共有12个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关气体体积的叙述正确的是( )
A.一定温度和压强下,各种气态物质体积的大小,由构成气体的分子大小决定
B.一定温度和压强下,各种气态物质体积的大小,由构成气体的分子数决定
C.不同的气体,若体积不同,则它们所含的分子数也不同
D.气体摩尔体积指1mol任何气体所占的体积约为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年8月13日中国科学家合成了首例缺陷诱导的晶态无机硼酸盐单一组分白光材料Ba2 [Sn(OH)6][B(OH)4] 2并获得了该化合物的LED器件,该研究结果有望为白光发射的设计和应用提供一个新的有效策略。
(1)基态Sn原子价层电子的空间运动状态有___种,基态氧原子的价层电子排布式不能表示为![]() ,因为这违背了____原理(规则)。
,因为这违背了____原理(规则)。
(2)[B(OH)4] -中氧原子的杂化轨道类型为____,[B(OH)4] -的空间构型为______。 [Sn(OH)6] 2-中,Sn与O之间的化学键不可能是___。
a ![]() 键 b σ键 c 配位键 d 极性键
键 b σ键 c 配位键 d 极性键
(3)碳酸钡、碳酸镁分解得到的金属氧化物中,熔点较低的是_____(填化学式),其原因是___________。
(4)超高热导率半导体材料——砷化硼(BAs)的晶胞结构如下图所示,则1号砷原子的坐标为____。已知阿伏加德罗常数的值为NA,若晶胞中As原子到B原子最近距离为a pm,则该晶体的密度为__g·cm-3(列出含a、NA的计算式即可)。
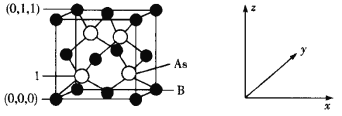
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质能用括号内的试剂等鉴别的是 ()
A.![]() 和
和![]() 两种溶液(焰色反应)
两种溶液(焰色反应)
B.NaCl和![]() 两种溶液(激光笔)
两种溶液(激光笔)
C.![]() 溶液
溶液![]() 两种溶液(NaOH溶液)
两种溶液(NaOH溶液)
D.![]() 和
和![]() 两种溶液(KSCN溶液)
两种溶液(KSCN溶液)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com