
一定条件下,将3 molA和1 molB两种气体混合于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g) x C(g)+ 2D(g)。2 min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2mol·L
x C(g)+ 2D(g)。2 min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2mol·L 下列判断正确的是
下列判断正确的是
A.B的转化率为80%
B.A的平均反应速率为0.6mol·(L·min)
C.此时若移走0.2molC和0.4molD,则C的体积分数将增大
D.此时若再加入1molB,达平衡时,A的转化率将是B的2倍
科目:高中化学 来源: 题型:
一种新型燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷
和氧气,其总反应为:2C2H6+702+8KOH 4K2C03+10H20,有关此电池的推断正确的
4K2C03+10H20,有关此电池的推断正确的
是( )。
A.负极反应为:14H20+702+28e- 280H-
280H-
B.放电一段时间后,负极周围pH升高
C.每消耗1 mol C2H6,则电路上转移的电子为14 mol
D.放电过程中KOH的物质的量浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:
CO(g) +H2O(g)  CO2(g) +H2 (g) △H<0。
CO2(g) +H2 (g) △H<0。
(1)CO和H2O浓度变化如右图,则在该温度下,该反应的平衡常数K= 。 0~4min的平均反应速率v(CO)=_____mol·L-1·min-1。若降低温度,该反应的K值将 ,该反应的化学反应速率将 (填“增大”“减小”或“不变”)。
(2)在相同容器中发生上述反应,当温度高于850℃时, 容器内各物质的浓度变化如下表。
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
① 表中3min~4min之间反应处于______状态; c 1数值_____0.08 mol·L-1 (填大于、小于或等于)。
②反应在4min~5min间,平衡向逆方向移动,可能的原因是_________
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
(3)在相同温度下(850℃),若起始时c(CO)=1mol·L-1,c(H2O)=2mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应是否达到平衡状态 (填“是”与“否”),此时v(正) v(逆)(填“大于”“小于”或“等于”),你判断的依据是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法或表示方法正确的是
A. 氨气的燃烧热为-316.3kJ·mol-1,则氨气燃烧的热化学方程式可表示为:
4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H= -316.3kJ·mol-1
B. 500℃、30MPa下,将0.5mol N2(g)和1.5molH2(g)置于密闭的容器中充分反应
NH3(g),放热19.3kJ,其热化学方程式为:
N2 (g) + 3H2(g)  2NH3(g) △H=-38.6kJ·mol-1
2NH3(g) △H=-38.6kJ·mol-1
C. 由C(石墨)= C(金刚石)△H=+1.90kJ·mol-1 ,可知金刚石比石墨稳定
D. 由H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ·mol-1,可知将含0.5molH2SO4的浓溶液
与含1molNaOH的稀溶液混合,放出的热量大于57.3 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
按要求填空。
(1)根据常温下氯化铵、氢氧化钡两种晶体混合搅拌反应的现象判断:
该反应△S 0,△H 0(均填“<”、“>”或“=”,下同);
(2)已知:升高温度时,反应2CH4(g)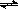 C2H4(g)+2H2(g)的平衡转化率增大,现有:
C2H4(g)+2H2(g)的平衡转化率增大,现有:
C(s)+2H2(g)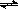 CH4(g) ΔH1;2C(s)+2H2(g)
CH4(g) ΔH1;2C(s)+2H2(g)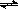 C2H4(g) ΔH2 则2ΔH1 ΔH2
C2H4(g) ΔH2 则2ΔH1 ΔH2
(3)在常温常压下测得:C(s)的燃烧热为393 kJ/mol,而1molC(s)燃烧成CO(g)放热110kJ,且6FeO(s)+O2(g)=2Fe3O4(s) ΔH=−480 kJ/mol。
请写出CO(g)还原Fe3O4(s)生成FeO(s)的热化学方程式:
;
(4)已知由气态分子断裂1mol以下共价键吸收的能量为:C-H:410kJ O=O:500 kJ C=O:750 kJ O-H:460 kJ,且常温下1mol水气化时吸收热量45kJ。写出常温下甲烷燃烧的热化学方程式:
;
查看答案和解析>>
科目:高中化学 来源: 题型:
引起下列物质颜色变化的化学方程式(或离子方程式)表示正确的是 ( )
A.暴露在空气中,淡黄色Na2 O2变成白色固体:Na2O2 +H2O 2Na+ +2OH-+O2 ↑
B.降温至-15℃时,红棕色NO2变成无色液体:2NO2  N2O4
N2O4
C.向AgCl悬浊液中加入硫化钠变黑:2Ag+ +S2- Ag2S↓
D.向CuSO4溶液中加入Ba(OH)2溶液,观察到有色沉淀生成:Cu2+ +2OH- Cu(OH)2↓
查看答案和解析>>
科目:高中化学 来源: 题型:
在温度t ℃下,某Ba(OH)2的稀溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,
向该溶液中逐滴加入pH=b的盐酸,测得混合溶液的部分pH如下表所示:
| 序号 | 氢氧化钡的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | 22.00 | 0.00 | 8 |
| ② | 22.00 | 18.00 | 7 |
| ③ | 22.00 | 22.00 | 6 |
(1)依据题意判断,t ℃____25℃(填“大于”、“小于”或“等于”),该温度下水的离子积Kw=_____。
(2)b=____________,原Ba(OH)2的稀溶液的物质的量浓度为_____________。
(3)该温度下,向1L硫酸与硫酸钠的混合溶液中加入3L该Ba(OH)2的稀溶液时,沉淀正好达
最大量,从所得溶液中取出4mL并加水稀释至20mL,测得溶液的pH为7,则原硫酸与硫酸
钠混合溶液的pH为_________,以及其中Na2SO4的物质的量浓度为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:

下列叙述正确的是( )
A.试剂X可以是氢氧化钠溶液,也可以是盐酸
B.反应①过滤后所得沉淀为氢氧化铁
C.反应②通入的过量Y是CO2气体
D.图中所示的转化反应①②都是氧化还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com